来源:BioArt
转录因子c-MYC (MYC) 在细胞的生长、代谢、组织发育以及恶性转化中均发挥着极为重要的作用,具有非常重要的生理和病理功能【1】。已知c-MYC与慢性细菌感染引发的肿瘤恶性转化和预后生存有关。虽然c-MYC调控着约15%的人类基因并在恶性转化中发挥着极为重要的作用,但是以往的大量研究却未能够找到特异性直接靶向c-MYC的有效分子,也因此c-MYC被认为是一个无成药性靶点(undruggable target)。由此,研究人员们转向了靶向c-MYC介导的转录机器,比如MAX, CDKs, BRD4, USPs等等,但效果有限【2】。
2021年2月11日,瑞典隆德大学Catharina Svanborg课题组在Nature Biotechnology上发表题为A bacterial protease depletes c-MYC and increases survival in mouse models of bladder and colon cancer 的研究文章,研究发现了尿路致病性大肠杆菌 (Uropathogenic E.coli, UPEC) 能够直接降解和间接抑制人细胞和小鼠组织中的c-MYC并延长小鼠膀胱癌和结肠癌模型的存活时间。

已知MYC在肾的生长和发育过程中起到了重要的作用【3】,而人幼年时期如果有严重的细菌感染则会影响肾脏的生长,提示着肾c-MYC水平可能会受到细菌感染的影响。为了研究细菌感染是否会影响宿主的c-MYC水平,研究人员在儿童泌尿道感染 (febrile urinary tract infection, UTI) 急性肾盂肾炎 (acute phelonephritis, APN) 和治疗后6个月的外周血样品中检测了MYC的mRNA表达水平。结果显示MYC的mRNA 水平在感染时显著降低,基因富集分析 (GSEA) 也显示了MYC相关的靶基因受明显下调。为了在实验水平上证明细菌感染是否会影响MYC的水平,研究人员将尿路致病性大肠杆菌UPEC处理人肾上皮细胞,检测发现尿路致病性大肠杆菌E.coli CFT073 和536菌株都能够快速降低c-MYC的蛋白水平,而无症状性菌尿大肠杆菌E.coli 83972菌株则不能影响c-MYC的水平,提示着细菌抑制c-MYC水平与病毒性有关。研究人员利用细菌上清与肾细胞的培养然后检测c-MYC的蛋白水平进一步证明了上述结果。以上的结果表明了c-MYC水平能够在UPEC感染过程中受到抑制。
其次,为了探究c-MYC受到细菌抑制的机制,研究人员选用了病毒性基因和毒力岛(pathogenicity island, PAIs)已经被鉴定清楚的UPEC E.coli 536菌株(图1.a)进行进一步研究。研究人员对E.coli 536菌株进行了PAIs特异性删减突变,并以此来进行功能缺失筛选实验。筛选结果显示,野生型E.coli 536能够在4小时内显著抑制MYC的蛋白水平,而缺失PAI I的E.coli 536不能影响MYC的蛋白水平,缺失PAI II毒力岛有部分影响,提示着毒力岛PAI I在调节MYC水平中起到了关键作用、毒力岛PAI II 有部分调节作用。研究人员对PAI I和PAI II的各个病毒性基因进行了缺失性突变,发现Hly I 和Hly II对c-MYC的水平有部分影响,提示着Hly的作用及其他序列对MYC水平的影响。进一步地,研究人员对PAI I进行了序列分段缺失突变,最后发现了PAI I中一段编码细菌ABC转运蛋白(ATP-binding cassette transporter)的序列起到了调节c-MYC水平的重要作用。通过添加不同金属离子发现此ABC转运蛋白介导Zn2+转运,并影响细菌中调节c-MYC水平的效应分子的表达和释放。
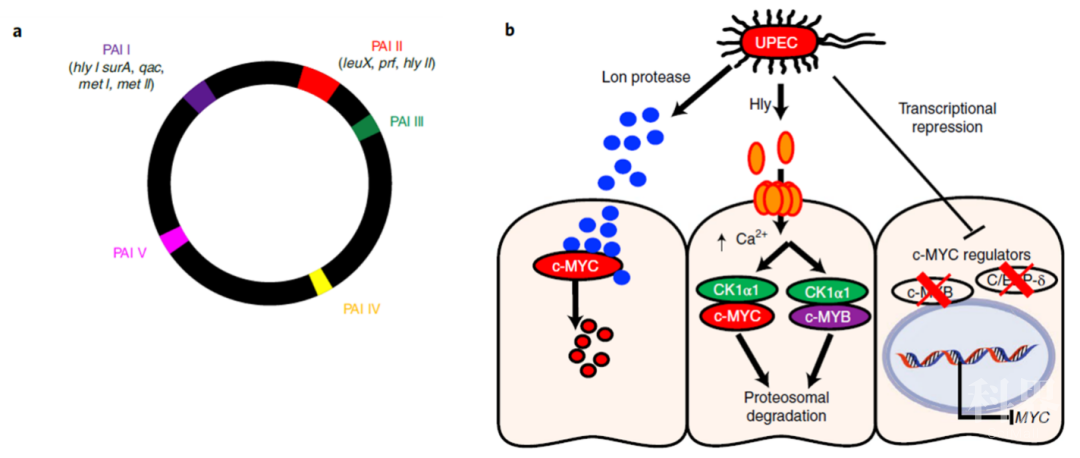
图1. a. E.coli 536染色体示意图;b. 细菌UPEC调节MYC水平的机制示意图
接着,研究人员考虑到c-MYC表达水平受到细菌的抑制作用是一个非常快速的过程,而c-MYC蛋白本身的半衰期是30分钟左右,因此他们推测细菌的效应分子可能参与到了c-MYC蛋白的降解过程。研究人员将细菌分泌的上清进行了质谱检测。质谱鉴定结果显示Lon蛋白酶(Lon protease)在细菌上清中大量富集,提示着Lon蛋白酶可能参与了c-MYC的直接降解途径。体外实验结果显示了重组Lon蛋白酶(rLon)与c-MYC蛋白反应后能够降解c-MYC蛋白,而进一步的质谱显示c-MYC的DNA结合结构域、丝氨酸富集区域和MAX结合结构域被降解了。共聚焦显微镜结果也显示rLon能够被人肾脏细胞吸收并降低c-MYC的水平。而缺失Hly和缺失Lon的E.coli 536则对c-MYC的抑制作用明显降低。除了直接的降解过程之外,研究人员还探讨了是否存在间接的降解过程。已知酪蛋白激酶I亚型α(CK1α1)能够磷酸化c-MYC的252位丝氨酸位点,研究人员检测发现E.coli 536细菌处理过的人肾脏细胞内CK1α1表达水平和活性都上升了,并且证明了Hly对于CK1α1的激活作用和对CK1α1依赖的c-MYC降解作用途径。
此外,研究人员进一步研究了UPEC能否影响转录调控因子从而调节c-MYC的mRNA表达水平。c-MYB是一个转录增强子,能够促进c-MYC的转录表达。而CCAAT 增强子结合蛋白delta CEBPD能够通过与E2F1/RB复合体结合抑制DNA的结合,从而抑制包括c-MYC在内的基因的表达。通过转录组数据分析发现E.coli 536能够调控MYB的靶基因。进一步地分析发现MYB本身的mRNA水平并不受细菌的调控,但其蛋白由Hly介导的蛋白质降解调控。另一方面,他们发现CEBPD在转录水平上就受到了细菌的调控,但具体被调控的机制与Lon或者Hly介导的降解方式无关。通过对临床APN样品的分析发现:MYB的表达水平在APN中是显著下降的而CEBPD则显著上升,提示着细菌能够通过影响转录调控因子c-MYB和CEBPD从而调控c-MYC的转录表达。至此,研究人员通过多种方法和不同角度进行了研究,揭示了细菌抑制c-MYC表达的三种机制(图1.b)。
最后,研究人员探讨了细菌产生的效应分子和重组rLon蛋白酶在肿瘤治疗中的效果和应用前景。研究人员首先利用细菌产生的效应分子即细菌上清,对多种肿瘤细胞进行了处理,实验结果显示细菌上清能够抑制多种肿瘤细胞中c-MYC的水平,而作为对照组的PAI I、Hly或者Lon 缺失突变的细菌上清不能够显著抑制c-MYC的水平。这些结果进一步证明了Lon蛋白酶和Hly蛋白在细菌抑制c-MYC水平过程中的重要作用。接着,研究人员使用rLon蛋白酶对小鼠肿瘤模型的治疗效果进行了评估。研究人员选取了小鼠膀胱癌模型和结肠癌模型,用rLon蛋白酶分别对这两个肿瘤模型小鼠进行了治疗观察。通过对小鼠肿瘤的观察,他们发现rLon蛋白酶能够显著抑制肿瘤的大小以及延长小鼠的生存时间。实验组小鼠的肿瘤中c-MYC表达水平显著低于对照组,表明了rLon蛋白酶能够有效降解小鼠肿瘤中c-MYC的水平并延长小鼠的存活时间。为了进一步说明rLon蛋白酶在临床方面的应用可行性,研究团队还分别采用了三种不同的方法检测了rLon蛋白酶的安全性,即1. rLon蛋白酶对人肾脏细胞的细胞活性没用毒性作用;2. rLon蛋白酶对健康C57BL/6小鼠没用毒性作用且小鼠组织中Myc水平不受明显影响;3. 转录组数据显示rLon蛋白酶处理的小鼠肿瘤模型中被调控的基因绝大部分是肿瘤相关的基因。这些结果证明了rLon蛋白酶的安全性及可应用性。
总的来说,该研究论文发现了重要的转录因子和癌基因c-MYC是细菌的一个靶点,UPEC感染一方面能够促进c-MYC蛋白的降解,另一方面能够抑制c-MYC的转录表达,从而抑制了c-MYC的水平。与此同时,本文的作者将细菌蛋白酶rLon运用到了癌症治疗上,证明了rLon蛋白酶在小鼠肿瘤模型中的有效性和安全性,为今后研究细菌在c-MYC异常表达肿瘤以及其他肿瘤的治疗上提供了新策略和新思路。
参考文献
1.Dang, C.V., MYC on the path to cancer. Cell, 2012. 149(1): p. 22-35.
2.Chen, H., H. Liu, and G. Qing, Targeting oncogenic Myc as a strategy for cancer treatment. Signal Transduct Target Ther, 2018. 3: p. 5.
3.Mugrauer, G. and P. Ekblom, Contrasting expression patterns of three members of the myc family of protooncogenes in the developing and adult mouse kidney. J Cell Biol, 1991. 112(1): p. 13-25.
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652525544&idx=3&sn=da9def153f510f94810489e571098d14
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn