来源:BioArt
免疫检查点抑制剂,如PD-1/PD-L1抗体药物,可以重新激活人体自身的免疫系统杀伤肿瘤细胞,为癌症患者带来新的曙光。令人遗憾的是只有少部分患者可以从该药物中获益,且机制不清。研究发现T淋巴细胞在肿瘤中的浸润水平与免疫检查点药物的疗效密切相关【1,2】。然而在肿瘤微环境中,大部分T淋巴细胞却积聚在肿瘤间质,似乎肿瘤细胞构建了一堵隐形的“城墙”,阻挡了T细胞浸润到癌巢内部。如果能拆掉肿瘤细胞的“城墙”,促进T细胞浸润,将有望提高免疫治疗的疗效。
近日,来自中山大学肿瘤防治中心和香港大学的关新元研究团队在Science Advances杂志上在线发表文章Laminin gamma 2–mediating T cell exclusion attenuates response to anti–PD-1 therapy,揭示了癌相关的成纤维细胞与肿瘤细胞相互作用,抑制T细胞浸润,降低PD-1抗体药物疗效的新机制。

目前,研究发现异常激活的TGF-β信号通路可以抑制免疫检查点药物的疗效,但机理尚未阐明【3,4】。该团队首先利用人源重组蛋白TGF-β1直接处理非小细胞肺癌(NSCLC)和食管鳞癌(ESCC)细胞,然后进行RNA测序分析。结果显示TGF-β信号可显著上调层粘连蛋白Laminin gamma 2(Ln-γ2)的表达。临床资料分析证实:Ln-γ2在对PD-1抗体药物耐受的肿瘤组织(Progressor)中的表达水平显著高于药物敏感组织(Responder),并且高表达Ln-γ2与高肿瘤负荷和患者不良预后密切相关。因此,Ln-γ2是一个有效的预测免疫检查点药物疗效的临床标志物,有助于指导肿瘤患者个体化用药(已申请发明专利:202010784683X)。
Ln-γ2是如何调控抗肿瘤免疫反应的呢?研究人员对肿瘤组织进行双重免疫荧光染色发现只有癌巢边缘的肿瘤细胞特异性地表达Ln-γ2蛋白,并且高表达Ln-γ2的肿瘤组织中浸润分布较少的T淋巴细胞(图1)。通过体外功能和机制研究,研究人员进一步发现Ln-γ2蛋白通过调控T细胞受体的表达进而抑制T细胞的浸润。因此,肿瘤细胞合成分泌的Ln-γ2蛋白类似一堵防御性“城墙”可以抵抗T细胞的攻击。
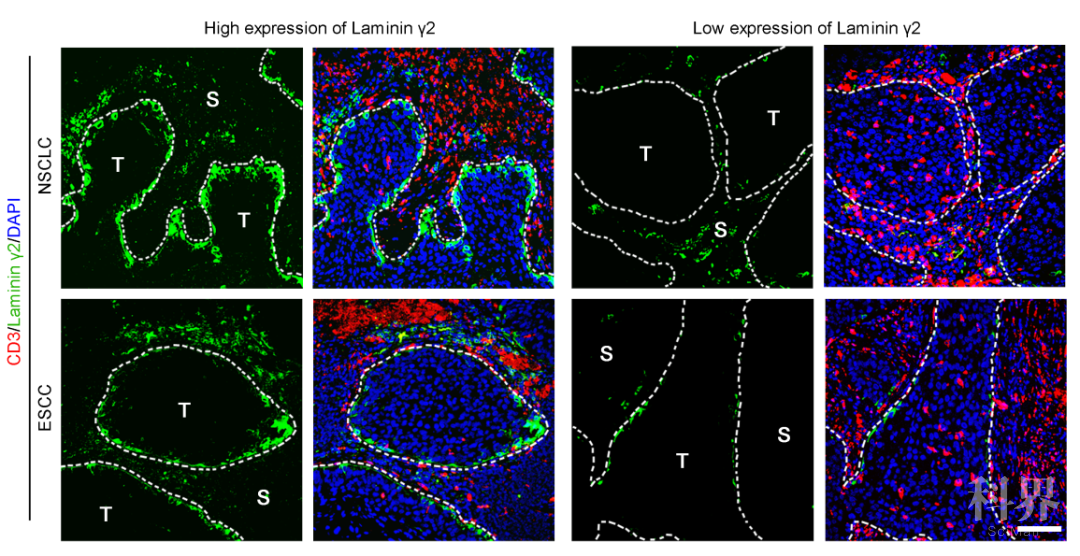
图1. 肿瘤细胞高表达Ln-γ2抑制T细胞浸润(T:肿瘤; S:间质)
肿瘤细胞又是如何构建这层防护屏障的呢?通过体外共培养系统,该团队证实癌相关的成纤维细胞可以分泌大量的TGF-β1直接作用于临近的肿瘤细胞,通过激活JNK/c-Jun/c-Fos信号通路促进Ln-γ2的表达。相反,TGF-β1中和性抗体或TGF-β受体抑制剂Galunisertib可以阻断成纤维细胞和肿瘤细胞之间的相互作用,抑制Ln-γ2的表达,促进T细胞的浸润(图2)。此外,研究人员还在小鼠移植瘤模型中证明:封闭TGF-β信号联合化疗药物可提高鼠源PD-1封闭抗体的抗肿瘤效果,有效地抑制肿瘤的生长。
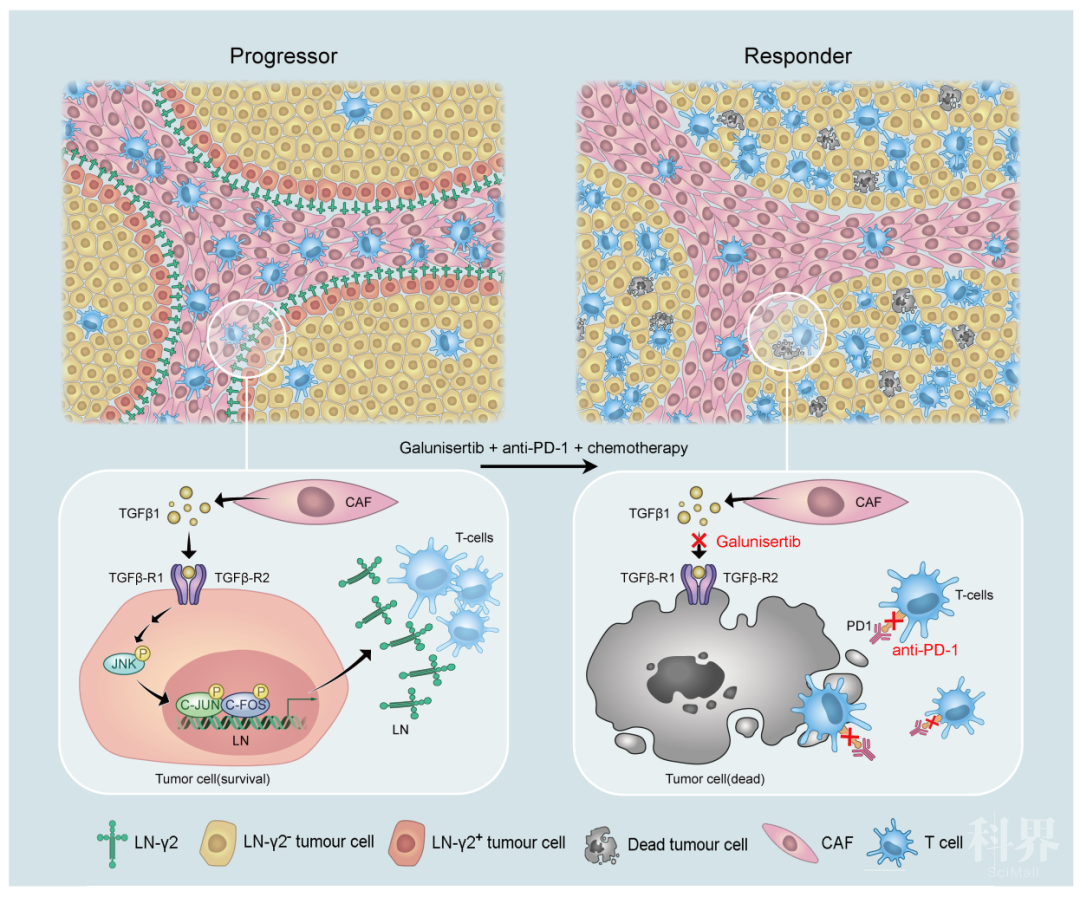
图2. 打破肿瘤细胞构建的Ln-γ2“城墙”可以激发强烈的抗肿瘤免疫反应
综上所述,癌相关的成纤维细胞可以帮助肿瘤细胞构建防御性“城墙”,将大量的T细胞阻挡在肿瘤间质,降低了免疫检查点药物的疗效。通过阻断成纤维细胞和肿瘤细胞的相互作用,打破肿瘤的“城墙”,将极大地提高杀伤性T细胞和肿瘤细胞“短兵相接”的机会,提高免疫治疗的疗效。因此,该治疗策略有望提高癌症患者的治愈率,改善患者预后。
中山大学肿瘤防治中心和香港大学的关新元教授和李雷博士为该论文的共同通讯作者。
原文链接
https://advances.sciencemag.org/content/7/6/eabc8346.full
参考文献
1.Garber K. Pursuit oftumor-infiltrating lymphocyte immunotherapy speeds up. Nature Biotechnology2019, 37(9):969-971.
2.Jiang P, Gu S, Pan D, Fu J, Sahu A,Hu X, Li Z, Traugh N, Bu X, Li B et al. Signatures of T cell dysfunction andexclusion predict cancer immunotherapy response. Nature Medicine 2018,24(10):1550-1558.
3.Tauriello DVF,Palomo-Ponce S, Stork D, Berenguer-Llergo A, Badia-Ramentol J, Iglesias M,Sevillano M, Ibiza S, Canellas A, Hernando-Momblona X et al. TGF-beta drives immune evasion in genetically reconstitutedcolon cancer metastasis. Nature 2018, 554(7693):538-543.
4.Mariathasan S,Turley SJ, Nickles D, Castiglioni A, Yuen K, Wang Y, Kadel EE, Koeppen H,Astarita JL, Cubas R et al. TGF-betaattenuates tumour response to PD-L1 blockade by contributing to exclusion of Tcells. Nature 2018, 554(7693):544-548.
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652524951&idx=6&sn=a4991b1ee49d08796eb08e65403f40be
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn