来源:中国科学院重大科技基础设施共享服务平台
1月12日,国家蛋白质科学研究(上海)设施用户山东大学武大雷教授课题组与卞小莹教授课题组及张友明教授课题组联合攻关,在非核糖体脂肽生物合成与工程化方面取得突破。相关研究成果以“Engineering and Elucidation of the Lipoinitiation Process in Nonribosomal Peptide Biosynthesis”为题,在线发表于Nature Communications。
非核糖体脂肽是一类重要的天然产物,如链霉菌来源的达托霉素和类芽孢杆菌来源的多粘菌素被认为是对抗革兰氏阳性菌和阴性菌感染的最后一道防线。脂肽类化合物的N端脂肪酸链可以进入细菌细胞膜的磷脂双分子层,对脂肽的生物活性和毒性具有重要的影响。因此,改变N端脂肪酸链可提高脂肽的成药属性,如达托霉素的创制。目前,改变其脂肪酸链主要依靠半合成法或改变脂肪酸前体供应等方法,相对复杂且产量较低。
课题组前期在一株伯克氏菌中通过基因簇激活发现了两类含有不同长度脂肪酸链的脂肽rhizomide和holrhizin。它们负责装载脂肪酸的Cs结构域,具有很高的同源度,但是其装载的脂肪酸链长度却有较大差异 (C2 vs C8)。研究人员首先利用Cs结构域交换手段,发现能够成功改变两类脂肽的脂肪酸链,确立了一种改变脂肽的脂肪酸链的遗传学方法(图1)。并进一步将全长Cs结构域交换的方法应用于Glidobactin A的脂链改造,也成功获得了脂肪酸链改变的衍生物,证明了该策略具有较好的普适性。
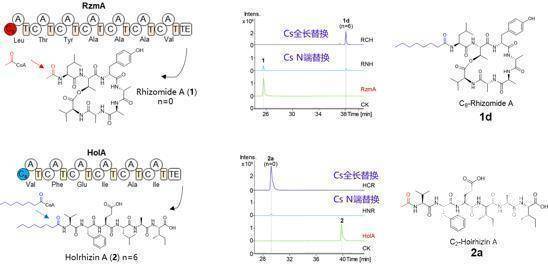
图1 非核糖体脂肽的生物合成以及利用Cs结构域替换改变rhizomide和holrhizin的脂肪酸链。
进而通过筛选与底物结合能力强的Cs结构域蛋白突变体,研究人员首次成功获得了Cs结构域与供体底物辛酰辅酶A的共晶结构,辅以结合位点的氨基酸突变实验,进一步确定了负责底物脂肪酸链长度的关键氨基酸,并实现了rhizomide的脂肪酸链长度从乙酰基到十六烷酰基(C2 - C16)的巨大改变,产生并鉴定了一系列的非天然脂肽(图2)。该研究通过Cs结构域替换和关键氨基酸突变,为非核糖脂肽的脂肪酸链改造提供了可行的策略和较为普适的方法,为复杂脂肽的组合生物合成和工程化改造奠定了理论和实践基础。
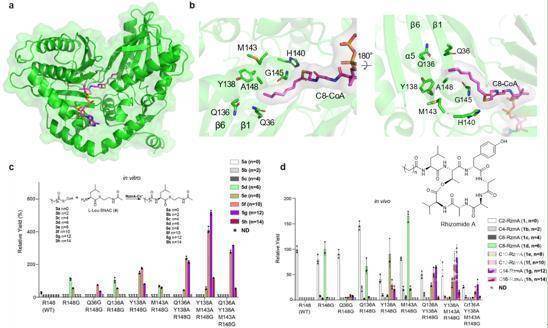
图2 Cs结构域与供体底物辛酰辅酶A的复合物结构(a)显示控制脂肪酸链长度的关键氨基酸(b),并通过体外(c)和体内(d)实验改变改变脂肪酸长度。
研究人员同时也获得了Cs结构域与供体底物辛酰辅酶A及受体底物模拟物的三元复合物结构,发现反应中心的组氨酸H140对两底物均具有稳定定位的作用。同时基于所获得的多种不同构象的Cs结构域精细结构,提出其在催化脂链起始过程中存在 “从底物结合到产物释放” 的动态结构变化模型,进一步揭示了Cs结构域的催化机理(图3)。
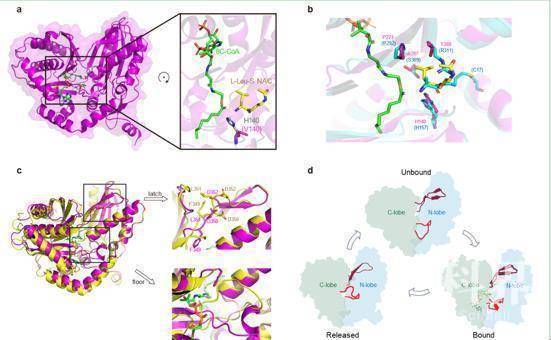
图3 Cs结构域与供体底物辛酰辅酶A及受体底物氨基酸(L-Leu-SNAC)的三元复合物结构(a,b)和Cs结构域的底物释放后的构象状态与未绑定底物的构象状态比较(c),以及Cs结构域催化脂链起始过程中存在的“从底物结合到产物释放”动态结构变化模型(d)。
国家蛋白质科学研究(上海)设施BL19U1线站,上海光源BL17U1线站工作人员为其X射线晶体学衍射数据收集提供了及时有效的支持。
(蛋白质设施上海提供)
来源:中国科学院重大科技基础设施共享服务平台
原文链接:http://lssf.cas.cn/lssf/dbzkxyjshss/xwdt/202101/t20210128_4560722.html
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



