近日,中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)研究员杨荟研究组、美国纪念斯隆凯特琳癌症中心教授Dinshaw J. Patel研究组和分子细胞卓越中心研究员丁建平研究组合作,在Molecular Cell上,在线发表了题为Structural basis for self-cleavage prevention by tag:anti-tag pairing complementarity in Type VI CRISPR-Cas systems的论文,揭示了目标RNA的anti-tag序列与crRNA重复区形成的RNA双链抑制Cas13a活性的分子机制。
CRISPR-Cas13系统是细菌和古细菌中通过单个Cas蛋白降解外源入侵RNA的获得性免疫系统,相应的效应蛋白Cas13在crRNA介导下序列特异性识别并切割单链RNA,被激活的同时会非特异性切割周围环境中的RNA。Cas13是新兴的RNA编辑工具,在不改变基因组序列的前提下,可以进行RNA水平的敲低、RNA的定点编辑、RNA的定位等,在基因和RNA的功能研究、疾病诊断和靶向治疗等方面具有潜力和应用前景。研究发现,当目标RNA靶向序列的下游可以与crRNA重复区的3’端(tag)连续配对时,对Cas13a的活性有显著抑制作用,防止宿主细胞Cas13 系统的自我靶向,与tag区域配对的序列称为anti-tag。
已有研究阐明了Cas13a对目标RNA特异性识别的分子机制,并发现目标RNA的装载使HEPN结构域从失活变为激活状态。在此基础上,科研人员对Leptotrichia shahii和Leptotrichia buccalis两种Cas13a进行体外酶活和体内RNA干扰研究,发现当目标RNA存在5nt以上anti-tag序列时,Cas13a对目标RNA和周围环境中的RNA的切割活性显著被抑制,对大肠杆菌细胞的RNA干扰活性显著降低。科研人员获得了含有8nt长度anti-tag序列的RNA与LshCas13a复合物的冷冻电镜结构,发现目标RNA的靶向区与crRNA间隔区形成RNA双链,同时目标RNA的anti-tag序列与crRNA的tag区形成的RNA双链。与已有结构比较发现,含有anti-tag序列的目标RNA的结合,引起Cas13a结构域的相对移动,使Cas13a呈现出与正常目标RNA装载前后均不相同的构象。Tag:anti-tag双链的形成,阻碍了HEPN结构域活性中心关键氨基酸的靠近,使HEPN结构域保持失活状态,抑制了Cas13a对目标RNA和周围环境中RNA的切割活性,影响在大肠杆菌细胞RNA干扰的效果。
研究工作得到中科院上海高等研究院张江实验室国家蛋白质科学研究(上海)设施电镜分析系统、南方科技大学冷冻电镜中心、上海科技大学冷冻电镜中心、浙江大学冷冻电镜中心、美国纪念斯隆凯特琳癌症中心电镜平台以及国家蛋白质科学研究(上海)设施BL18U1和BL19U1线站的支持。
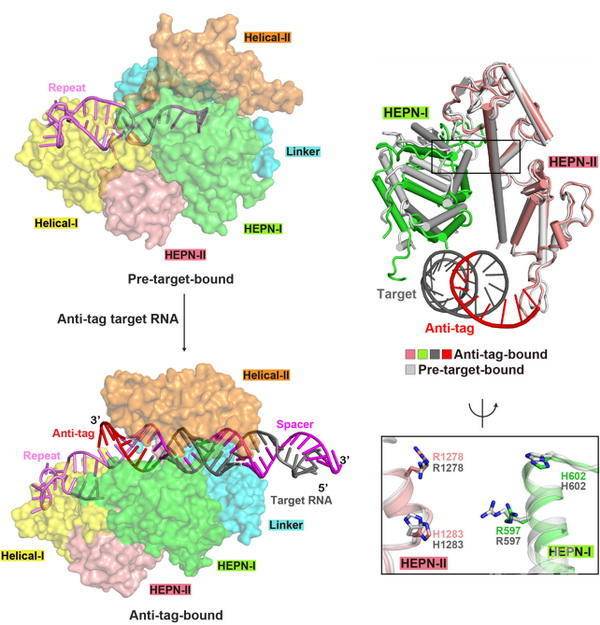
Anti-tag RNA的结合使HEPN结构域处于失活状态
来源:中国科学院
原文链接:http://www.cas.cn/syky/202101/t20210122_4775561.shtml
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn