来源:奇点网
肝脏很神奇,作为一个重要的免疫器官,它在诱导免疫耐受方面有独特的作用机制,包括广泛地诱导调节性T细胞激活和消除效应T细胞等[1,2],在自身免疫性疾病、病毒感染和器官移植中发挥重要作用[3]。
同时,在癌症患者中,肝脏还是一个常见的转移目的地。但研究人员发现,肿瘤转移到肝脏比转移到其他部位的预后更差,而且患者几乎无法从免疫疗法中获益。
为什么会这样?为了回答这个问题,美国密歇根大学的研究人员开展了一项研究,他们发现,肝转移肿瘤竟然能够改变肿瘤免疫微环境,将全身的CD8+T细胞“吸”到肝脏中,并让它们发生凋亡,遏制抗肿瘤免疫和免疫治疗的效果。研究结果发表在《自然·医学》杂志上[4]。
研究人员首先找到了两组转移性黑色素瘤患者,其中一组接受免疫治疗,另一组接受靶向治疗。分析结果表明,肝转移的存在和对免疫治疗的响应弱有关,但在靶向治疗组中不存在这种关系。同样的,在免疫治疗组中,肝转移和总生存期以及无进展生存期短也有关。在另外的分别接受免疫治疗和化疗的非小细胞肺癌患者中,也观察到了以上结果。
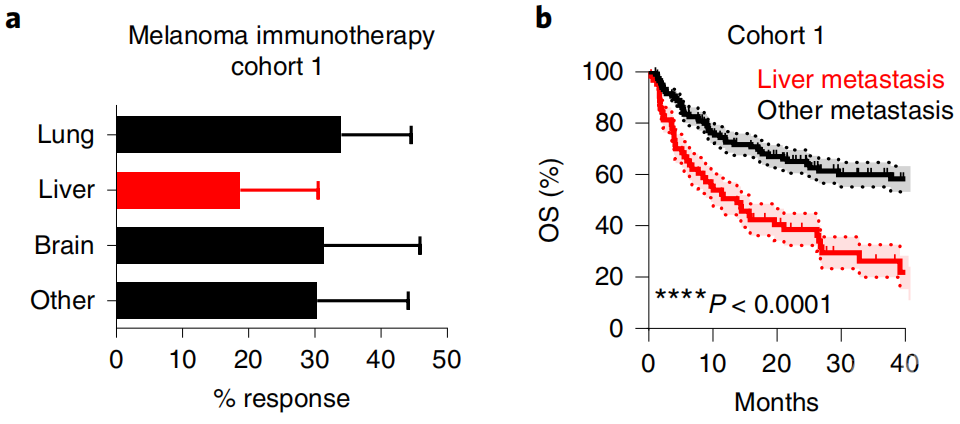
接受免疫治疗的转移性黑色素瘤患者中,a:肺、肝(红)、脑和其他转移的响应率;b:总生存期的对比
而同样是接受免疫治疗的黑色素瘤患者,只有肝转移的比只有肺转移的在免疫治疗中获益更少。
通过多变量分析,研究人员发现,在转移性黑色素瘤和非小细胞肺癌患者中,校正了临床病理学特征后,肝转移仍然是无进展生存期和总生存期预后差的相关因素。
对于接受免疫治疗的肝转移黑色素瘤患者,相比没有肝转移的,全身肿瘤负荷增加的频率更高,在免疫治疗失败的肝转移患者中,包含其它器官在内的进行性肿瘤生长造成了84%的患者全身性衰竭。这说明,肝转移可能会整体地改变抗肿瘤免疫。
同样的结果在一个包含转移性黑色素瘤、非小细胞肺癌、尿路上皮癌和肾细胞癌的复合型队列中也得到了验证。
和人类患者一样,肝转移的小鼠对抗PD-L1治疗也没有响应,而且肝转移的存在与皮下接种的肿瘤体积和重量的增加有关,这再次说明,肝转移可以干扰全身的抗肿瘤免疫。
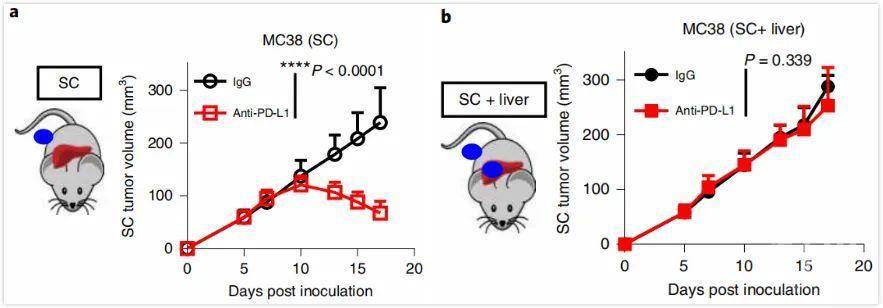 肿瘤体积在a:仅皮下注射(SC)接种肿瘤小鼠IgG和抗PD-L1治疗;b:SC和肝转移共存的小鼠IgG和抗PD-L1治疗后的变化
肿瘤体积在a:仅皮下注射(SC)接种肿瘤小鼠IgG和抗PD-L1治疗;b:SC和肝转移共存的小鼠IgG和抗PD-L1治疗后的变化
对于仅有皮下肿瘤的小鼠来说,抗PD-L1治疗大量增加了CD8+T细胞在肿瘤中的浸润,但存在肝转移的小鼠则没有,看来,肝转移有可能是通过调节CD8+T细胞来影响免疫治疗疗效的。
从小鼠的肿瘤中分离出的肝单核细胞的单细胞RNA测序结果显示,和没有肝转移的相比,肝转移小鼠单核细胞衍生的巨噬细胞比例增加,T细胞比例减少,而且增加的巨噬细胞中,大部分是M2型,也就是抑制免疫的巨噬细胞,也就是说,肝转移通过募集巨噬细胞和改变巨噬细胞的表型,改变了肝脏的免疫微环境。
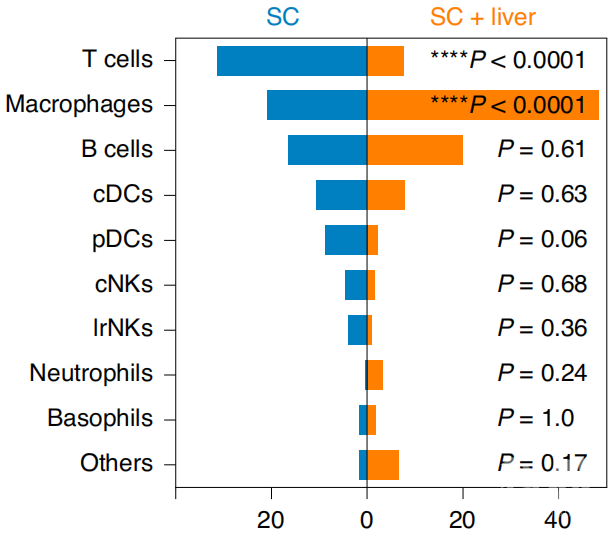
皮下注射接种肿瘤(蓝)和具有肝转移(橙)小鼠T细胞、巨噬细胞(前2)等免疫细胞的数量
在肝转移小鼠的肝脏中,CD8+T细胞的数量显著增加,相应的,皮下肿瘤中、未被肿瘤累及的宫颈淋巴结和外周血中,CD8+T细胞的都减少了。在一组患有乳腺、肠癌、前列腺癌、黑色素瘤或非小细胞肺癌且仅存在肝转移的人类患者中,肿瘤内的T细胞减少,多样性也降低,与没有肝转移的患者相比,CD8+T细胞的功能性削弱。
说回小鼠,经过检测,它们肝脏中的CD8+T细胞表达了高水平的T细胞迁移有关的淋巴细胞功能相关抗原-1(LFA-1)和CD44,而这两个分子的受体则在肝脏中具有高表达,也就是说,通过这种方式,肝转移肿瘤将CD8+T细胞从其他组织中“吸”了过来。
吸过来还不算完,这些CD8+T细胞凋亡的发生率还显著增加了,实验表明,表达FasL的单核细胞衍生的巨噬细胞通过Fas-FasL途径,和表达Fas的CD8+T细胞进行了“友好交流”,诱导了它们的凋亡。
这一步又一步真是够缜密的,不过研究人员发现,通过放疗,或许能改变故事的发展。因为放疗之前就在肝脏肿瘤中有很多应用,且在临床前研究中被证明可以刺激抗肿瘤免疫。
于是研究人员对肝转移的小鼠进行了单独定向放疗、单独抗PD-L1治疗或两种疗法结合,结果显示,放疗减少了巨噬细胞的比例,增加了T细胞浸润,还使得MHC-I和PD-L1表达增加。除了数量增加,CD8+T细胞的凋亡也显著减少。
在此基础上,接受联合治疗的小鼠皮下肿瘤消退,存活时间显著延长。
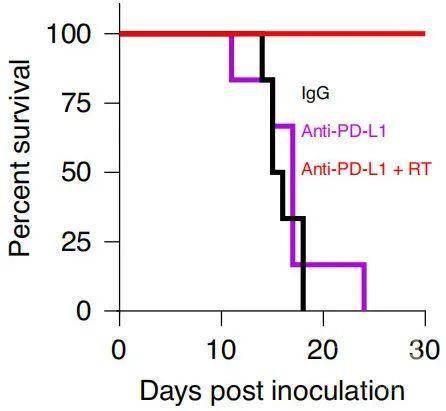
IgG抗体治疗(黑)、单独抗PD-L1治疗(紫)和抗PD-L1+放疗联合治疗(红)的小鼠存活情况
总的来说,这项研究的结果表明,肝转移肿瘤可以通过改变免疫微环境和抗原表达募集全身的抗肿瘤CD8+T细胞,并且让它们发生凋亡,导致肿瘤的全身性进展,并且抑制免疫治疗的起效,而通过放疗和免疫治疗结合,能够消除这些影响,重新赋予免疫治疗有力的抗肿瘤作用。
研究的通讯作者Michael D. Green表示,“这有可能真正改变这些患者的预后”。
参考资料:
[1] Crispe I N. Hepatic T cells and liver tolerance[J]. Nature Reviews Immunology, 2003, 3(1): 51-62.
[2] Crispe I N, Dao T, Klugewitz K, et al. The liver as a site of T-cell apoptosis: graveyard, or killing field?[J]. Immunological reviews, 2000, 174: 47-62.
[3] Li F, Tian Z. The liver works as a school to educate regulatory immune cells[J]. Cellular & molecular immunology, 2013, 10(4): 292-302.
[4] https://www.nature.com/articles/s41591-020-1131-x
来源:geekheal_com 奇点网
原文链接:http://mp.weixin.qq.com/s?__biz=MzA4MjA2MDI5OQ==&mid=2659494208&idx=1&sn=8bf91c078b35fb86cde8d70e955a4706
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



