来源:BioArt
原标题:Advanced Science: 复旦柳素玲组揭示免疫抑制相关分子IL1R2调控乳腺肿瘤干细胞的机制及其靶向干预策略
国内外的研究表明,包括乳腺癌在内的多种肿瘤组织内存在一小部分致瘤能力特别强、分化程度极低的细胞,它们具有干细胞的自我更新及多向分化特性,称为“肿瘤干细胞(cancer stem cells),在乳腺癌中亦可称为乳腺肿瘤起始细胞(breast tumor initiating cell)。乳腺肿瘤起始细胞的富集被认为是造成肿瘤异质性,进而导致癌症复发以及放化疗治疗抵抗的重要原因【1】。AI-Hajj, Max S. Wicha教授等在2003年提出并确定标记乳腺肿瘤起始细胞的CD24-CD44+分子组合【2】,2007年他们课题组再次发现乙醛脱氢酶(Aldehyde dehydrogenase, ALDH)同样可以标记乳腺肿瘤起始细胞【3】。后续的研究显示,这两种分子标志物代表的乳腺肿瘤起始细胞群具有一定区别和联系,柳素玲教授的前期研究便发现这两种分子标志物分别标记了乳腺肿瘤起始细胞群的两种形态,即上皮-间质细胞转化样(CD24-CD44+,间质样)形态和间充质-上皮细胞转化样(ALDH+,上皮样)形态,相对应地分别在乳腺癌的转移和增殖过程中发挥着关键作用【4】。而两种分子标志物共同标记的ALDH+CD24-CD44+乳腺癌细胞则是更小一群具有相对更强成瘤能力、转移能力和耐药能力的乳腺肿瘤起始细胞群。针对ALDH+CD24-CD44+乳腺肿瘤起始细胞的全转录组测序提示,这群细胞中干细胞多潜能相关信号通路和肿瘤微环境重塑相关分子表达出现了激活【5】,但具体的分子调控机制仍需要更多的研究和探索。
2019年11月14日,复旦大学生物医学研究院/附属肿瘤医院柳素玲课题组在Advanced Science杂志发表题为IL1R2 Blockade Suppresses Breast Tumorigenesis and Progression by Impairing USP15-Dependent BMI1 Stability的文章,揭示了免疫抑制相关分子IL1R2维持乳腺肿瘤细胞干性和促进乳腺癌发展的具体分子机制。

为了探索ALDH+CD24-CD44+乳腺肿瘤干细胞群的关键调控分子及其靶向干预策略,该研究团队从构建三阴性乳腺癌病人来源的移植瘤(PDX)模型小鼠做起并成功分选出移植瘤组织中干性最强的ALDH+CD24-CD44+乳腺肿瘤起始细胞,并对它们进行RNA 测序分析。而后他们将乳腺肿瘤起始细胞中获取的差异表达基因与直接来着于乳腺癌患者的乳腺癌和癌旁正常乳腺组织的RNA 测序结果进行了比较,发现免疫抑制相关分子IL1R2 在乳腺肿瘤干细胞和乳腺癌组织中表达显著上调。白介素1受体2(Interleukin 1 receptor type 2, IL1R2)是一种白介素1(Interleukin 1)诱饵受体,它可以通过与白介素1受体1(Interleukin 1 receptor type 1, IL1R1)相似的胞外结构域竞争性地结合共同的配体IL1α或IL1β,同时由于IL1R2相比于IL1R1缺少胞内的TIR结构域,因而最终竞争性抑制了IL1/NFκB信号通路的激活。
柳素玲教授团队的分析结果显示,IL1R2 基因表达水平和乳腺肿瘤起始细胞所占比例密切相关,并影响了肿瘤细胞的生长和迁移,以及乳腺肿瘤起始细胞的自我更新。高表达IL1R2 的乳腺癌患者往往预后不良。机制上, RNA-seq分析发现IL1R2参与了BMI1相关信号通路调控。该研究团队通过通过大量实验证明,IL1β可以与IL1R2结合并促进IL1R2的胞内段发生剪切和释放,胞内段IL1R2(ICD-IL1R2)而后可以与位于细胞核内的去泛素化酶USP15相结合,促进了USP15对BMI1的去泛素化酶活性,最终稳定了BMI1在乳腺肿瘤起始细胞中的表达。BMI1是PRC1复合物的核心成分, 过去的研究显示BMI1在干细胞的自我更新和分化过程中发挥了重要的调控作用【6】。不仅如此,该团队为了探索IL1R2作为乳腺肿瘤治疗靶点的潜力,自行订制了IL1R2中和性抗体并进行了大量体内外实验,研究结果显示IL1R2特异性中和性抗体可以显著地降低乳腺癌细胞中IL1R2和BMI1蛋白的表达,同时还可以有效抑制体乳腺肿瘤细胞的生长、转移和干性维持。
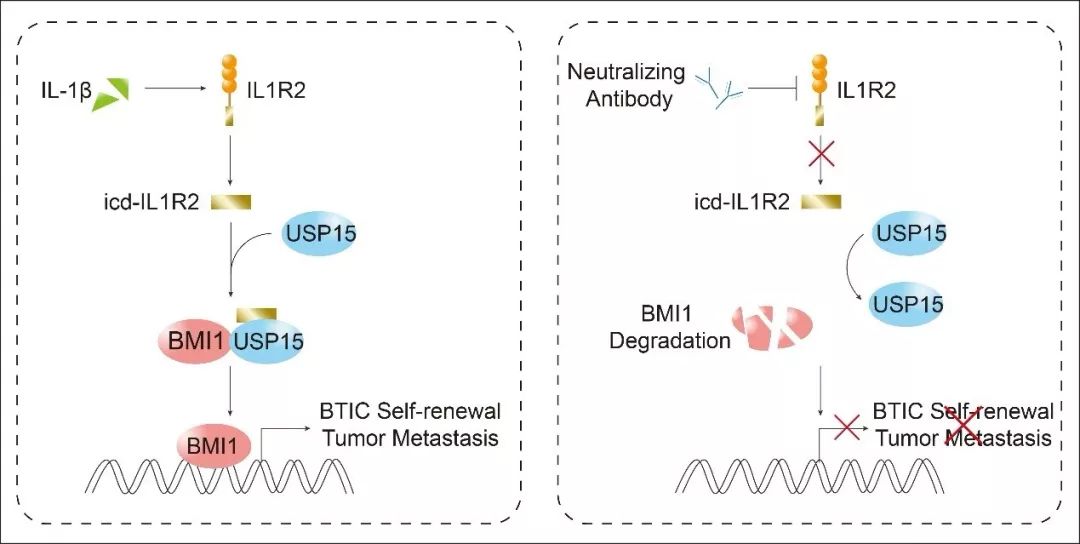
综上,该研究为针对乳腺癌靶向治疗在乳腺肿瘤起始细胞这个突破口上找到了一个明确有效的靶点。
据悉,复旦大学生物医学研究院/附属肿瘤医院张立行副研究员、博士研究生强健坤、杨小利为论文共同第一作者,柳素玲教授为通讯作者。
原文链接:
https://onlinelibrary.wiley.com/doi/full/10.1002/advs.201901728
参考文献
【1】 H. Lu, L. Tran, Y. Park, I. Chen, J. Lan, Y. Xie, G. L. Semenza, Cancer Res. 2018, 78, 4191; b) S. Koren, M. Bentires-Alj, Mol. Cell 2015, 60, 537.
【2】M. Al-Hajj, M. S. Wicha, A. Benito-Hernandez, S. J. Morrison, M. F. Clarke, Proc. Natl. Acad. Sci. USA 2003, 100, 3983.
【3】C. Ginestier, M. H. Hur, E. Charafe-Jauffret, F. Monville, J. Dutcher, M. Brown, J. Jacquemier, P. Viens, C. G. Kleer, S. Liu, A. Schott, D. Hayes, D. Birnbaum, M. S. Wicha, G. Dontu, Cell Stem Cell 2007, 1, 555.
【4】S. Liu, Y. Cong, D. Wang, Y. Sun, L. Deng, Y. Liu, R. Martin-Trevino, L. Shang, S. P. McDermott, M. D. Landis, S. Hong, A. Adams, R. D’Angelo, C. Ginestier, E. Charafe-Jauffret, S. G. Clouthier, D. Birnbaum, S. T. Wong, M. Zhan, J. C. Chang, M. S. Wicha, Stem Cell Rep. 2014, 2, 78.【5】M. Liu, Y. Liu, L. Deng, D. Wang, X. He, L. Zhou, M. S. Wicha, F. Bai, S. Liu, Mol. Cancer 2018, 17, 65
【6】D. Chen, M. Wu, Y. Li, I. Chang, Q. Yuan, M. Ekimyan-Salvo, P. Deng, B. Yu, Y. Yu, J. Dong, J. M. Szymanski, S. Ramadoss, J. Li, C. Y. Wang, Cell Stem Cell 2017, 20, 621.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652477739&idx=5&sn=c5f3200dc51e2ab4f1412a1b70e46a7e&chksm=84e20a9fb39583894252ad0665f72055b3100f81ca98d8f357e98f7cc6dbd4285328c597287b&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



