来源:精准医学与蛋白组学
2020年,由SARS-CoV-2即新型冠状肺炎病毒引发的非典型肺炎(COVID-19)对全球人类健康和社会经济造成巨大威胁,目前累计感染并导致近百万人死亡,理解新冠肺炎病毒感染机制以及寻找合适用药对于疫情防控至关重要。已有研究显示,新冠肺炎病毒基因组至少编码27种蛋白,包括4种结构蛋白(spike [S], envelope [E], membrane [M], nucleocapsid [N])、15种非结构蛋白和8种辅助蛋白,这些蛋白与宿主因子相互作用进而引发宿主应答。
目前关于新冠肺炎病毒感染分子机制在包括Vero E6(永生化的非洲绿猴肾细胞)[2],Caco-2(人结直肠腺癌细胞)[3] 和A549(人肺基底癌细胞)[4] 等细胞体系中已经有了深入的探索,但这些研究成果与人肺部感染后的病理特征相关性却很有限。研究表明SARS-CoV-2在侵染宿主时会优先感染2型肺泡上皮细胞(AT2s),并且AT2s损伤是COVID-19发病机制的关键,因此解析SARS-CoV-2驱动的肺部病变机制对于理解该疾病以及后续的治疗都具有非常重要的意义。
2020年12月17日,来自波士顿大学的Andrew Emili和波士顿大学医学院的Elke Muhlberger等研究人员合作在Molecular Cell 上发表了最新研究成果 [1],利用蛋白组和磷酸化修饰组学针对新冠肺炎病毒感染iAT2s的动态调控展开研究,揭示了宿主系统在病毒感染后快速重塑的信号通路和机体应答,并预测和验证了COVID-19发病机制的新靶标,为理解新冠肺炎病毒感染机制和治疗策略提供新见解。
Graphical Abstract
1. SARS-CoV-2感染人类iAT2细胞的磷酸化/蛋白质组分析
由于原代的2型肺泡上皮细胞很难在体外培养,所以研究者首先通过近些年被广泛研发和使用的体外诱导多能干细胞体系诱导培养2型肺泡上皮细胞(iAT2s)(样本策略),并对新冠肺炎病毒感染iAT2s四个时间点即1h、4h、6h和24后收集的样本展开TMT标记的定量蛋白组和磷酸化修饰组学研究(质谱策略)。结果共鉴定到8,471个蛋白(其中有8个病毒蛋白)以及2,703个宿主蛋白和2个病毒蛋白上的14,289个磷酸化位点。其中差异蛋白有2,872个,包括对AT2s细胞表面活性剂功能至关重要的marker SFTPA2;同时也鉴定到4,688个差异的磷酸化位点,这些位点定位在1,166个特异性在肺部表达的蛋白上。
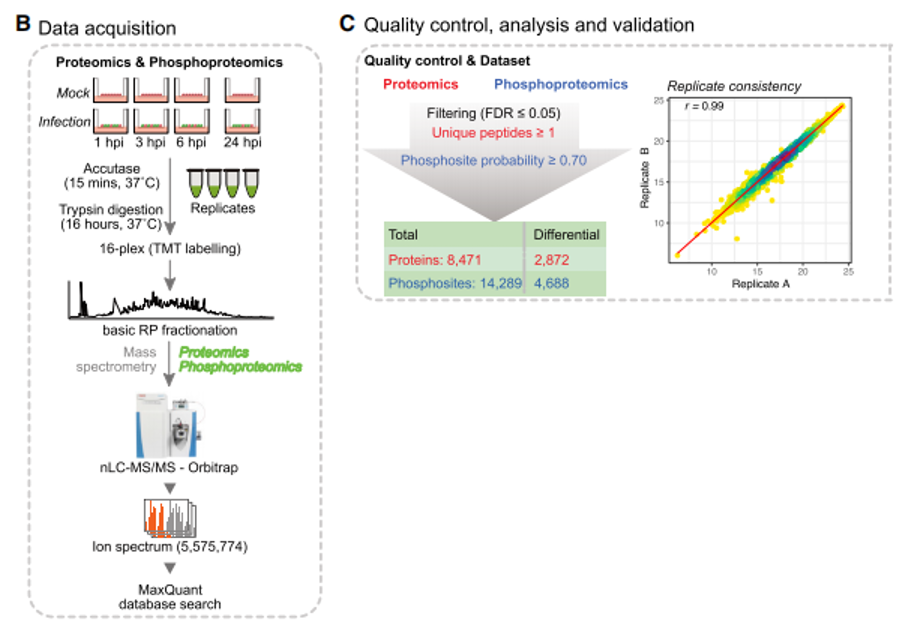
图1. SARS-CoV-2感染人类iAT2细胞的磷酸化/蛋白质组分析
2. 病毒感染引起iAT2s中宿主蛋白表达的改变
为了揭示iAT2细胞作为宿主在起始阶段对病毒感染的应答,研究者采用监督聚类的方法对早期感染时间点即1-6小时的表达蛋白展开分析,结果显示宿主蛋白富集四个不同的分组对应即刻感染1h,早期感染3h以及中后期感染3-6小时。Cluster 1与病毒侵入后的迅速应答相关,富集感染和免疫蛋白、NF-kB活化和C型凝集素受体(比如ITCH,ATF2,IKBKB)等。mTOR介导的翻译起始在病毒侵入后也很快发生改变,引发宿主蛋白在3-6小时大量增加;同时线粒体相关蛋白在3-6小时也显著增加,提示为后续病毒复制所需的能量做储备。Cluster 2-4富集的蛋白与细胞增殖调控相关,比如细胞周期进程相关检查点激酶ATR、细胞死亡效应蛋白CASP7/8以及细胞周期调控蛋白BUB1B。同时,免疫荧光染色实验结果显示病毒感染后PCNA表达减少,说明病毒感染诱导iAT2细胞间期阻滞。
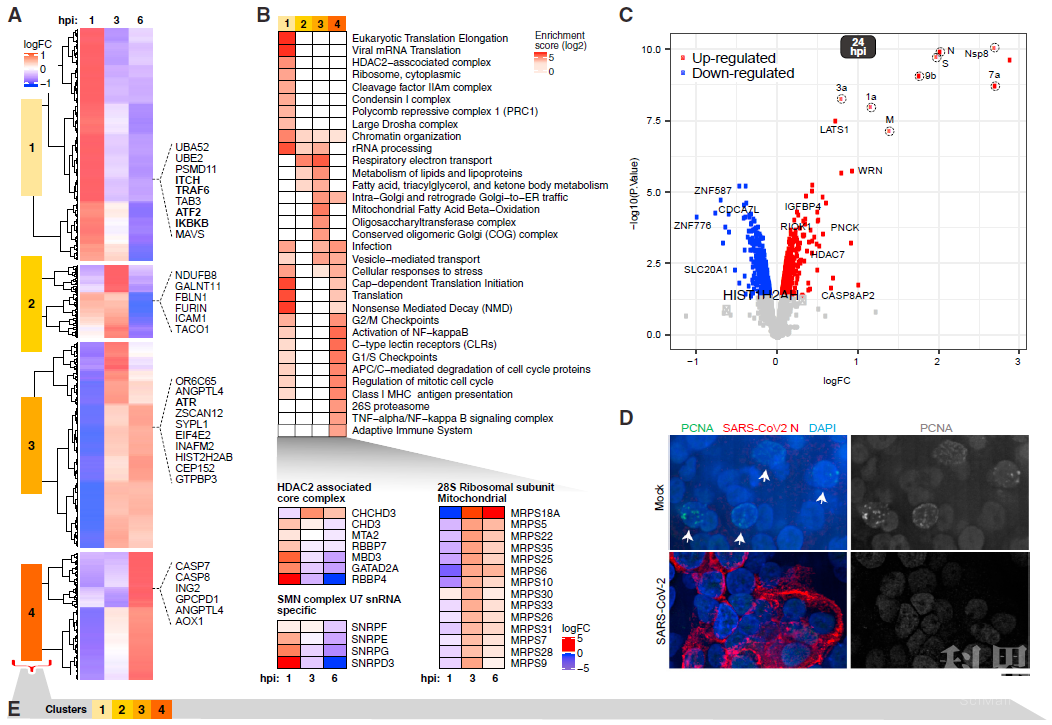
图2. 病毒感染引起iAT2s中宿主蛋白表达的改变
3. 磷酸化修饰组分析揭示宿主和病毒应答机制
接下来研究者针对病毒感染的磷酸化信号调控展开分析包括病毒和宿主。首先研究者在感染24小时的病毒膜(M)蛋白和核衣壳(N)蛋白上鉴定到磷酸化修饰,其中核衣壳蛋白在RNA结合和二聚体domain区域之间有9个位点,膜蛋白主要是在C端胞质区域有2个位点,同时结合序列分析和体外激酶实验证明,GSK3B和CK2这两个激酶可以磷酸化核衣壳蛋白,并对病毒侵染复制至关重要。进一步研究者采用监督聚类分析的方法将早期感染时间点即1-6小时宿主磷酸化蛋白聚类成四个Cluster,和蛋白组聚类一致。Cluster 1富集侵染相关通路比如病毒RNA合成、核糖核蛋白输出、翻译起始以及宿主蛋白合成。Cluster 3-4富集RNA加工,细胞增殖/存活和蛋白质合成等信号通路。
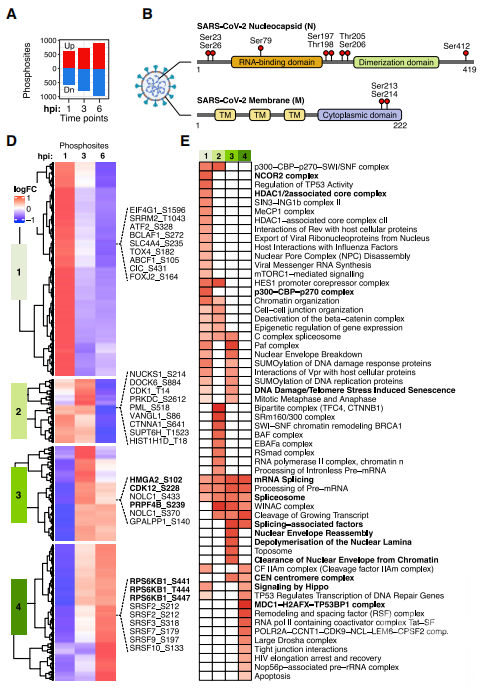
图3. 磷酸化修饰组分析揭示宿主和病毒应答机制
4. SARS-CoV-2病毒侵染iAT2s细胞应答机制验证
前面的研究结果提示SARS-CoV-2病毒感染会诱导mTOR介导翻译的关键调控蛋白RPSK6B1的改变,研究者通过免疫印迹对该通路的活化展开验证。结果显示,病毒感染的iAT2s细胞中,参与到宿主翻译过程的RPS6和AKT磷酸化增强,同时与翻译抑制相关的非磷酸化4E-BP1显著减少。MAPK可以通过磷酸化和失活TSC2复合物来活化RPS6KB1和4E-BP1进而减少对mTOR的抑制,WB结果表明MAPK1的磷酸化水平增加,表明其催化活性增强并促进翻译。同时,结合RNA-seq以及RT-PCR分析,研究者证明病毒侵染主要通过改变宿主mRNA剪切,破坏宿主蛋白表达,进而促进病毒复制。
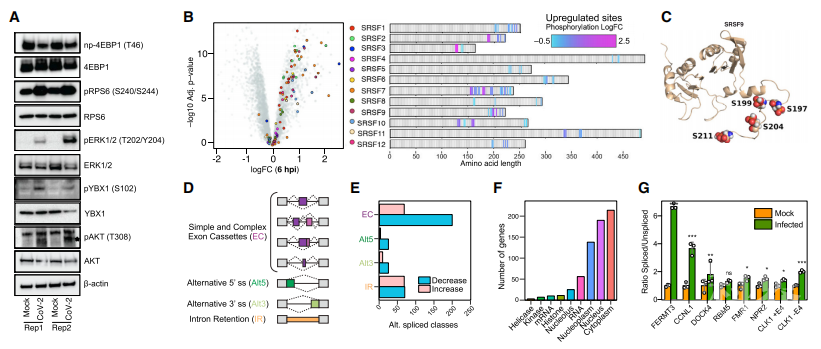
图4. SARS-CoV-2病毒侵染iAT2s细胞应答机制验证
小 结
新冠肺炎病毒感染2型肺泡上皮细胞(AT2s),导致肺损伤和气体交换受损,但引发感染和病理的机制目前尚不清楚。本篇文章通过蛋白组和磷酸化修饰组对诱导多功能干细胞衍生的AT2s即iAT2s感染病毒动态过程展开研究,结果表明宿主系统在病毒感染后会快速重塑,包括信号传导,RNA加工,翻译,代谢,蛋白运输等,进而导致细胞周期停滞,遗传毒性应激和天然免疫应答,为理解新冠肺炎病毒感染机制和治疗策略提供新见解。
来源:ptm-biolab 精准医学与蛋白组学
原文链接:http://mp.weixin.qq.com/s?__biz=MjM5NDM5NjQxOA==&mid=2650455264&idx=1&sn=0e76f89a10505060ae2e565d1541d7b5
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



