来源:ACS美国化学会
供稿:张妍,北京大学
大家好,今天为大家介绍一篇ACS Chem. Biol.的文章“Protein Folding Stability Changes Across the Proteome Reveal Targets of Cu Toxicity in E. coli”,文章来自于杜克大学的Michael C. Fitzgerald课题组。在这篇文章中,作者首次将全蛋白质组的蛋白质折叠稳定性测量与蛋白质表达水平分析相结合,从而鉴定到大肠杆菌中多种铜的靶标蛋白,发现这些蛋白参与了包括代谢、翻译及细胞氧化还原稳态维持等多种重要生物学过程,并证明蛋白质稳定性测量可以提供许多独特信息,帮助破译药物作用模式研究中的金属依赖过程。
金属-蛋白相互作用在细胞生理过程中十分常见且发挥着重要作用。细胞通过调控金属运输和稳态来调节金属-蛋白相互作用,以避免由于金属不足、过量或错位造成的功能障碍。在诸多相关金属中,铜受到的调控最为严格,说明铜稳态对细胞有着极其重要的意义。金属离子载体因为可以诱导细胞内金属积累从而具有强大的抗菌活性,羟基吡啶硫酮(PT)与其可被β-内酰胺酶(β-lactamase)激活的前药PcephPT均可造成铜在大肠杆菌中的过度积累从而实现杀菌效果,但是这背后的机制与靶点尚不清楚。此前已有研究表明,铜离子会影响蛋白折叠,而蛋白质的构象特征与其功能息息相关,因此本文作者通过测量蛋白质折叠稳定性来鉴定大肠杆菌中金属离子载体作用前后铜的蛋白靶点。
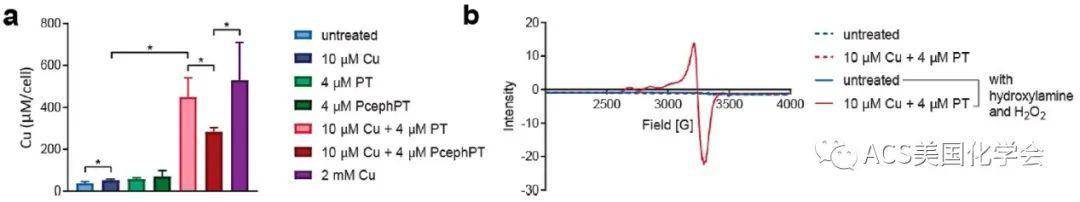
图1. PT与PcephPT增加了细胞中Cu+含量。a. 不同条件处理后大肠杆菌中铜含量变化情况;b. 大肠杆菌经不同条件处理后的全细胞EPR谱图。
首先,作者验证了PT与PcephPT均可提高细胞中铜离子的含量。他们将表达β-lactamase的大肠杆菌用致死浓度以下的Cu、PT与PcephPT处理15分钟,结果表明在低浓度Cu与PT或PcephPT共同作用以及高浓度Cu单独作用时,细胞均出现铜积累的现象。之后他们结合电子顺磁共振(EPR)实验验证了细胞中的铜为游离的一价还原状态(图1)。
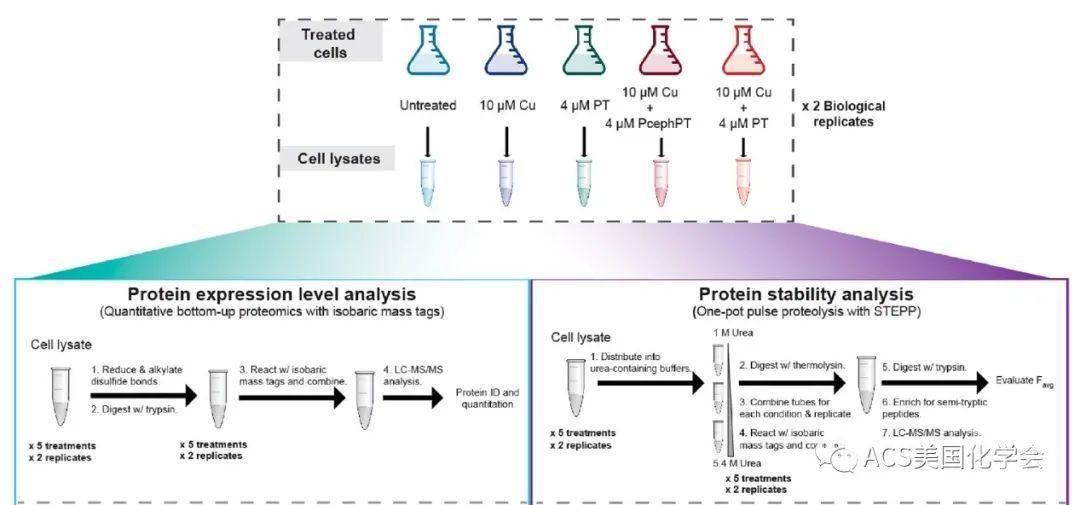
图2. 蛋白表达水平(左)和蛋白稳定性(右)分析的实验工作流程。
之后,作者对铜与金属离子载体作用后的大肠杆菌进行了蛋白质折叠稳定性与蛋白表达含量的测量(图2)。在测量蛋白质折叠稳定性时,作者采用了此前建立的蛋白水解程序的半胰蛋白酶解肽段富集策略(STEPP,Anal. Chem. 2018, 14039) (图3),首先用不同浓度的尿素溶液处理样品,之后利用嗜热菌蛋白酶(thermolysin)进行蛋白降解。折叠不稳定的蛋白将更容易被切割,从而产生肽段。接下来将样品中所有裸露的氨基进行保护,再用胰蛋白酶进一步降解蛋白,从而再暴露出裸露的氨基。之后利用新暴露的氨基对第二步降解产生的肽段进行富集与移除,实现对折叠不稳定的蛋白肽段选择性的质谱鉴定。
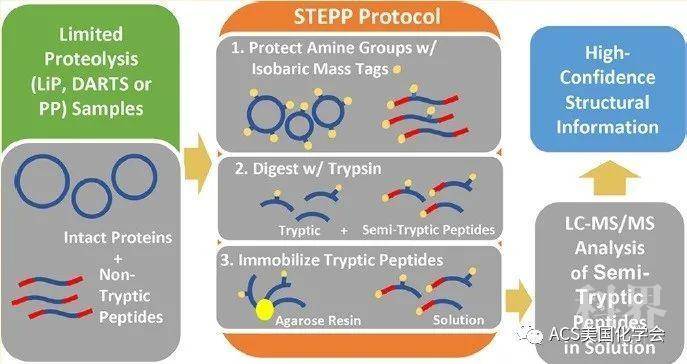
图3. STEPP实验流程示意图(Anal. Chem. 2018, 14039)。
与蛋白表达水平分析得到的结果相比,利用前述方法,作者鉴定到了大肠杆菌中更多的铜作用靶点,两者鉴定到的蛋白数量约有3倍差异,这说明蛋白折叠稳定性的测量可以提供更独特丰富的分子水平信息。之后作者对鉴定到的肽段进行了进一步的分析,发现铜被金属离子载体输送入细胞时会破坏多种细胞通路。
最后,作者验证了铜导致的蛋白折叠稳定性变化将一定程度影响蛋白质功能。他们以甘油醛-3-磷酸脱氢酶(GAPDH)与异柠檬酸脱氢酶(IDH)为例,用细胞裂解液与纯化的蛋白作为样品,验证了铜通过与蛋白互作从而影响其折叠稳定性进而影响其功能(图4)。
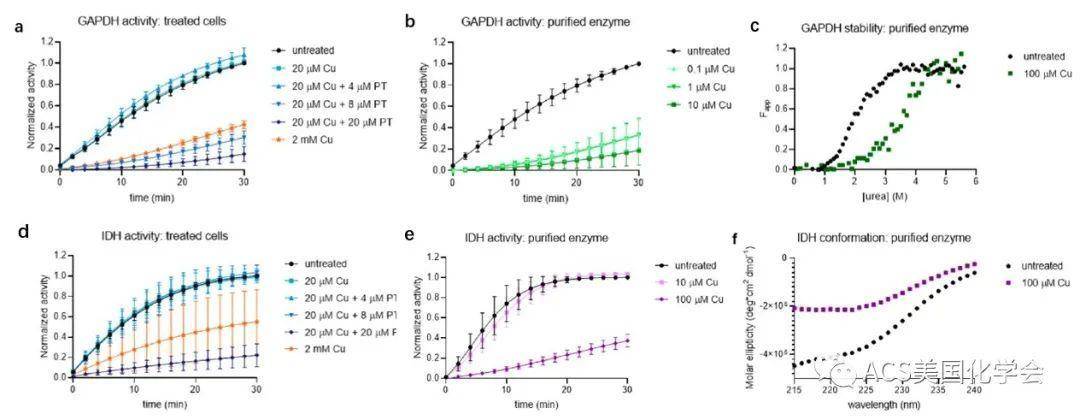
图4. GAPDH和IDH活性的变化与稳定性和构象的变化相关。a, d. 不同条件处理下大肠杆菌细胞裂解液中GAPDH与IDH的活性测定;b, e.纯化的GAPDH与IDH在不同条件处理下的活性测定;c. 圆二色光谱显示不同条件下GAPDH的稳定性差异;f. 圆二色光谱显示不同条件下IDH构象差异。
总之,这项工作利用蛋白折叠稳定性测量的方法揭示了铜的积累会对细胞中多种蛋白造成影响,并将该方法与蛋白表达水平分析进行比较,说明其可以提供更为深入丰富的信息,可以帮助研究蛋白质-金属和蛋白质-药物之间的相互作用,从而深入了解药物作用模式背后的复杂机制。
扫描二维码阅读英文原文

来源:gh_0320d0d498b4 ACS美国化学会
原文链接:http://mp.weixin.qq.com/s?__biz=MzIyMjgzMzI0Ng==&mid=2247510044&idx=1&sn=66ed1bbbd76c939c442e661f59b75ca3
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn


