来源:BioArt
蛋白的翻译后修饰(post-translational modifications,PTMs)与几乎所有的控制细胞和生物命运的过程相关。通过改变蛋白质的化学状态,PTMs极大地丰富了蛋白质的功能。目前,我们对PTMs的了解大多始于用化学的方法合成相应的多肽。这种方法促进了相关实验方法和试剂等的开发【1】。然而,对一些重要的,更复杂的PTMs,携带该PTMs的多肽的合成仍存在挑战。
ADPr(adenosine diphosphate-ribosylation),即ADP-核糖化,指ADP-核糖基团与蛋白质的共价连接。ADPr经NAD+水解产生,由相应的转移酶,如ADPr聚合酶家族蛋白PARPs,将其添加到蛋白质上。ADPr化是一个可逆的修饰,PARG和ARH3都是去ADPr化酶。ADPr修饰广泛地参与了许多重要的生理过程,包括病菌的致病,DNA损伤修复,癌症和神经系统疾病等。特别地,靶向ADPr被认为是癌症治疗的有效方法,多种PARP抑制剂也已投入临床使用。然而,与ADPr的重要性相反,我们对ADPr如何行使功能尚不了解【2】。这主要是由于ADPr本身的化学性质特殊,使得目前还未有ADPr修饰多肽和ADPr位点特异性抗体。
近日,来自德国马克思普朗克衰老研究所的Ivan Matic教授在Cell发表研究An HPF1/PARP1-Based Chemical Biology Strategy for Exploring ADP-Ribosylation ,该研究通过化学生物学的方法合成了携带特异位点ADPr修饰的多肽,并由此得到了相应的抗体,进一步利用该工具揭示了在DNA损伤中单ADPr修饰的广泛存在。

在DNA损伤修复中,组蛋白的丝氨酸是PAPR1的主要靶标,并且PARP1的催化活性严格地依赖组蛋白PAR化因子1(HPF1)。为得到特定丝氨酸位点携带ADPr修饰的多肽,研究者首先利用化学的方法合成了一段多肽,同时给非靶点的丝氨酸加上磷酸化修饰。磷酸化的丝氨酸不能被ADPr修饰。因此只有靶点位置的丝氨酸可以被PARP1/HPF1复合物加上ADPr。最后,研究者用去磷酸化酶去除磷酸化修饰,就能得到携带特定位点ADPr修饰的多肽了(图1)。
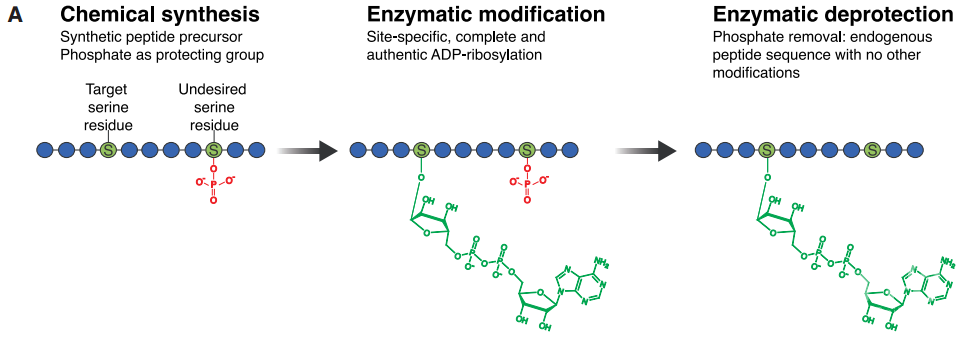
图1
接下来,研究者利用ADPr化的PARP1S499和H3S10多肽得到了相应的抗体。PARP1具有多聚ADPr(poly-ADPr)活性【3】。有趣的是,研究者利用以上抗体发现在DNA损伤修复中,PARP1和H3更倾向出现单ADPr化(mono-ADPr)而非多聚ADPr。进一步的研究发现,PARP1/HPF1复合物在DNA损伤修复中介导了瞬时的多聚ADPr,多聚ADPr很快被去ADP化酶PARG识别,转变为稳定的单ADPr;而单ADPr最终被ARH3去除(图2)。
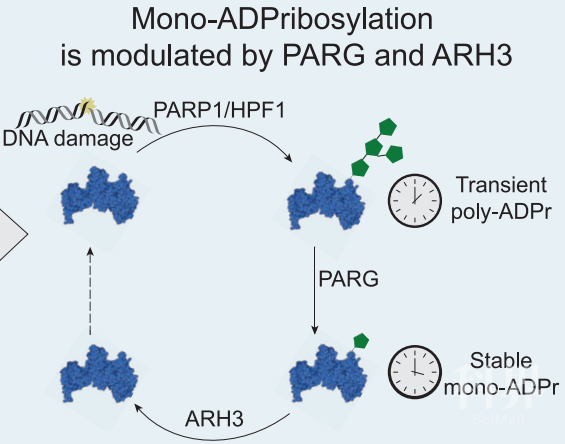
图2
总的来说,该研究利用化学生物学的方法首次获得了位点特异性的ADPr修饰多肽,并进一步获得了相应的抗体,揭示了DNA损伤修复中ADPr水平的动态调控,具有重要意义。值得注意的是,该研究发现的单ADPr化的PARP1和H3在DNA损伤修复中的广泛存在,提示单ADPr可能像其他PTMs一样,具有调节蛋白活性或蛋白质与蛋白质间互作的功能。该研究以Resource的形式发表,相信会为ADPr研究提供有利的资源和助力!
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652515355&idx=3&sn=5667c231b4b9b1e4a6c351410cd6b381
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



