来源:BioArt
乳腺癌(BRCA)生物学的异质性对个性化治疗提出了较高的要求,现在的精准治疗常将靶向DNA修复缺陷、激活的蛋白激酶、雌激素受体(ER)和肿瘤微环境中免疫反应等方法进行联合。这些方法的有效联合依赖于我们对肿瘤治疗敏感性的判断,而目前BRCA早期阶段的判定方法(如mRNA为基础的诊断检测)达不到需求【1】。虽然越来越多的复杂的基因组学技术应用于后期BRCA,但对结果的理解和临床考量是非常具有挑战性的,很多反复出现的突变目前是没有可用药。此外,近年来引进的治疗方法,如CDK4/6和免疫检查点抑制剂,也没有强有力的预测性生物标志物,可能导致病人错失治疗的时机或过度治疗【2】。
蛋白质基因组学是一种将二代DNA和RNA测序与基于质谱的蛋白质组学相结合,提供蛋白质和翻译后修饰(如磷酸化)的深入、无偏差的量化方法【3】。临床蛋白质组肿瘤分析联合会(CPTAC)致力于对多种癌症类型进行深入的蛋白质基因组学分析,利用TCGA的参与样本对BRCA进行初步的蛋白质基因组学分析,证明了蛋白质基因组学有助于BRCA的分析。但是,能够进行深层蛋白质组学分析的TCGA样本较少,大多不能通过蛋白质组学质量评估,而且收集样本过程中没有注意对蛋白质翻译后修饰的保护。所以,目前缺乏对癌症样本全面的蛋白质基因组学分析。
近日,来自Broad的D.R. Mani、Steven A. Carr、Michael A. Gillette、贝勒医学院的Matthew J. Ellis和临床蛋白质组肿瘤分析联合会(CPTAC)合作在Cell杂志上发表文章Proteogenomic Landscape of Breast Cancer Tumorigenesis and Targeted Therapy,收集122个未治疗的原发性乳腺癌,同时保存蛋白质的磷酸化和乙酰化等翻译后修饰,进行蛋白质基因组学分析。蛋白质基因组学的结果挑战了现有的乳腺癌诊断标准,可提供ERBB2扩增子的详细分析,定义了可从免疫检查点治疗中获益的肿瘤亚群,提供Rb状态更准确的评估以预测CDK4/6抑制剂的反应性。磷酸蛋白质组学研究可揭示肿瘤抑制因子丢失和靶向激酶之间的新联系。乙酰化蛋白质组分析突出了参与DNA损伤反应的关键核蛋白的乙酰化作用,揭示了细胞质和线粒体乙酰化、代谢之间的相互作用。研究揭示了蛋白质基因组学可用于更精准地鉴定乳腺癌的靶向途径和生物学特征,在乳腺癌临床研究中具有强大潜力。

研究人员首先收集未治疗的原发性肿瘤,收集过程中控制组织的缺血以保存蛋白质的翻译后修饰。肿瘤被冷冻粉碎得到单一均匀样本,提取DNA、RNA和蛋白质进行分析,得到蛋白质基因组学数据,共鉴定出29647个体细胞突变、23692个基因水平的拷贝数变异,23121个基因转录本、10107个蛋白、38968个磷酸化位点和9869个乙酰化位点。利用非负矩阵因式分解(Non-negative Matrix Factorization,NMF)进行多元组学分析,定义出4个NMF簇,分别是NMF LumA-I、NMF Basal-I、NMF LumB-I和NMF Her2-I。其中NMF LumA-I、NMF Basal-I和传统的肿瘤分类方法PAM50所判定的较为一致,而NMF LumB-I和NMF Her2-I则与PAM50亚型分类具有不一致。例如,NMF LumB-1还包含部分PAM50 LumA样本。PAM50作为一种用于临床的简化分类方法,对LumA和LumB的生物差异性无法全部鉴定。对磷酸化蛋白质数据进行分析以鉴定出每种NMF亚型中假定的治疗靶点,发现之前研究中PAM50亚型所观察到富集的激酶在这个数据集的NMF亚型中也能观察到,包括NMF Basal-I亚型中PRKDC、MAP4K4和SPEG;NMF HER2-I样本中的ERBB2和CDK12;以及NMF-LumA-I样本中的DCLK1。同时,利用BlackSheep方法可将磷酸化激酶异常值与反复出现的体细胞突变相关联。而对核蛋白Ac进行无偏差聚类发现NMF Basal-I肿瘤中存在两个亚组:N-Ac Basal-I C1和N-Ac Basal-I C3,其中N-Ac Basal-I C1显著高表达多个DNA修复途径的相关蛋白。两者的相应蛋白水平并没有差异,但特定Ac位点的修饰水平具有差异。
在蛋白质组水平对肿瘤代谢特征进行分析,将差异性表达的代谢相关蛋白进行无偏差聚类,分成4个簇的存在,且其很好地反映4种NMF簇的特征。分析蛋白质乙酰化修饰,发现NMF Basal-I簇中TCA循环和β-氧化蛋白的乙酰化(Ac)上调,而NMF LumB-I簇中葡萄糖代谢和IL-1信号相关蛋白的乙酰化上调。Ac水平在细胞不同部位也有不同的分布。与LumB-I相比,大多数差异性表达的线粒体Ac位点在NMF Basal-I上调,2/3的差异性表达的胞质Ac位点下调,这意味着NMF Basal-I亚型中Ac在细胞内不同部位具有特异性调节。这表明主要的细胞质和线粒体代谢途径在NMF Basal-I和LumB-I亚型之间存在差异调节。
对接受辅助治疗anti-ERBB2的ERBB2+ BRCA病人样本进行蛋白质基因组学分析,发现除了ERBB2扩增且蛋白上升的肿瘤,还存在缺乏ERBB2扩增的肿瘤和“假ERBB2+”肿瘤(即有ERBB2扩增,但蛋白水平较低)。而将ERBB2阳性和HER2分类进行相关联,发现所有PAM50 HER2E/ERBB2 PG+(PG+是蛋白质基因组学阳性)样本都具有高水平的ERBB2磷酸化,而PAM50 HER2E/ERBB2 PG-样本具有显著较低的ERBB2磷酸化,但其他ERBB家族成员以及MAPK信号通路的磷酸化水平上调。利用基于RNA的免疫细胞去卷积特征和免疫调节因子的蛋白质水平特征定义出四种BRCA亚型的免疫相关特征。CD3+ T细胞的浸润代表着有活跃的免疫肿瘤微环境(I-TME)。分析发现获得性免疫反应的特征在LumA中通常不被激活,而其他PAM50亚型,包括LumB,表现出与获得性免疫激活一致的特征,表明具有活跃的I-TME的luminal肿瘤可以考虑进行免疫治疗。APOBEC3G蛋白与PD-L1、免疫状态具有相关性,且APOBEC富集的肿瘤中具有更高的突变负荷,表明APOBEC驱动的突变产生可能有助于形成活跃的免疫微环境。而与PD-L1表达成负相关的过程包括单链断裂修复(SSBR)过程,SSBR蛋白的低表达和活跃的肿瘤免疫状态在PAM50 luminal肿瘤中特异出现,而在basal-样肿瘤中没有观察到。即luminal BRCA中,SSBR蛋白的缺失或促进肿瘤免疫。
最后,研究人员展示了蛋白质基因组学可用于分析Rb状态,而Rb蛋白的低表达确实导致肿瘤对CDK4/6抑制剂和palbociclib治疗响应性较低,而与RB1基因是否突变无关。即蛋白质基因组可提升用药的精准性。
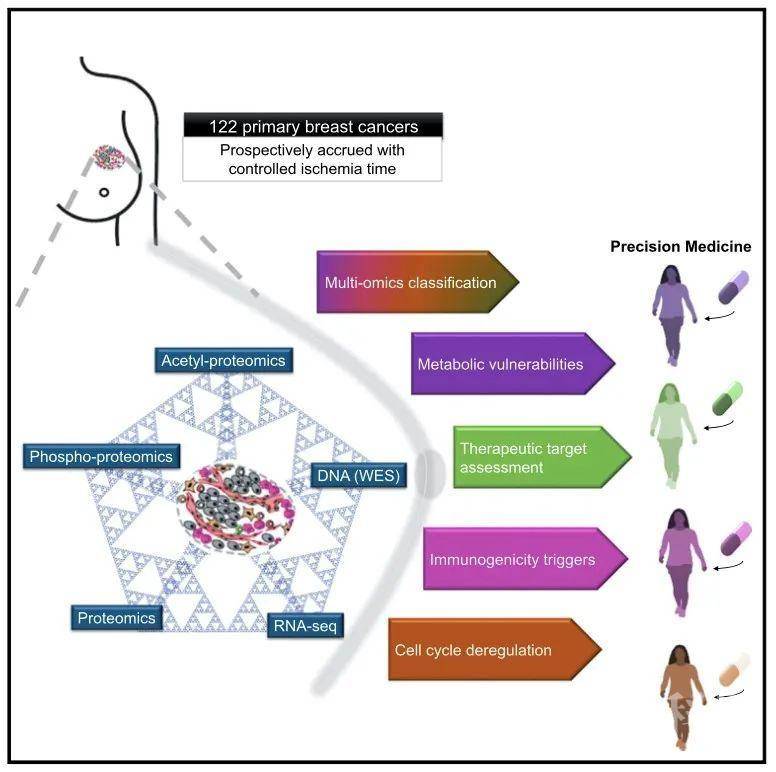
总的来说,研究对122例原发性乳腺癌的蛋白质基因组分析提供了临床相关生物学的见解,包括细胞周期失调、肿瘤免疫原性、异常代谢和治疗靶点表达的异质性,有助于优化现有的临床乳腺癌分型、治疗用药精准性等,展示了蛋白质基因组学在乳腺癌临床研究中的潜力。
参考文献
1. Coates, A.S.,Winer, E.P., Goldhirsch, A., Gelber, R.D., Gnant, M., Piccart- Gebhart, M., Thü rlimann, B., and Senn, H.-J.; Panel Members (2015). Tailoringtherapies–improving the management of early breast cancer: St Gallen Inter-national Expert Consensus on the Primary Therapy of Early Breast Cancer 2015.Ann. Oncol. 26, 1533–1546.
2. O’Leary, B., Finn, R.S., and Turner, N.C.(2016). Treating cancer with selective CDK4/6 inhibitors. Nat. Rev. Clin.Oncol. 13, 417–430.
3. Ruggles, K.V., Krug, K., Wang, X., Clauser,K.R., Wang, J., Payne, S.H., Fenyo ̈ , D., Zhang, B., and Mani, D.R. (2017).Methods, tools and current perspectives in proteogenomics. Mol. Cell.Proteomics 16, 959–981.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652514403&idx=4&sn=0a949a9266a9226c424e58ac8996eba8
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn




