来源:BioArt
骨髓纤维化的特征是过度的瘢痕组织逐步替代骨髓中的造血细胞。原发性骨髓纤维化(Primary myelofibrosis,PMF)是骨髓纤维化进行性发展的典型疾病。PMF的标志性特征是细胞外基质的过度沉积。然而这一过程中骨髓中非造血性细胞的变化特征尚不清楚。
在实体器官纤维化中,间充质基质细胞(Mesenchymal Stromal Cells,MSCs)被认为是纤维化驱动细胞的主要来源。已有报道发现在骨髓中,MSC是促进纤维化的驱动细胞,但是它们是否是骨髓微环境中纤维化驱动细胞的唯一来源仍未知。
2020年12月9日,来自荷兰Erasmus医学中心Rebekka K. Schneider团队在Cell Stem Cell 上发表题为 Heterogeneous bone-marrow stromal progenitors drive myelofibrosis via a druggable alarmin axis 的文章。通过单细胞转录组分析小鼠和人骨髓纤维化中骨髓基质细胞组成,确定了纤维化驱动细胞和潜在机制。

作者利用ThPO诱导的BM纤维化模型来分析非造血性BM细胞。作者分别分析了纤维化前阶段和纤维化阶段两个时期的非造血性BM细胞。利用单细胞转录组分析共确定了八种细胞亚型,八种细胞亚型定义为四种类型。
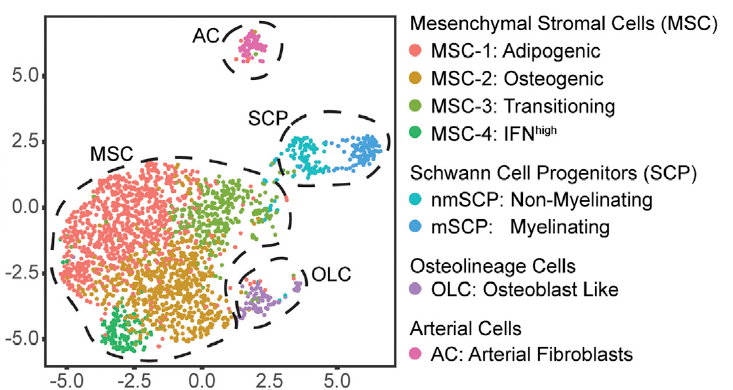
八种细胞亚型
鉴定出的细胞均存在于疾病模型小鼠和对照组中,只是细胞组成发生明显变化。在纤维化小鼠中,MSC-1和OLC增加,而MSC-3和MSC-4则下降。mSCP细胞扩增最明显。已有报道证明SCP具有高再生潜力,对于维持造血干细胞具有重要作用。因此作者推测mSCP可能受到MPN中的骨髓增殖刺激而扩增。分析基因表达变化,作者发现MSC-1和MSC-2细胞中细胞外基质表达水平明显上调,表明这两种细胞是纤维化进程的细胞驱动力,获得肌成纤维细胞特性。进一步分析作者发现上调的基因主要分布于四个生物学过程:分泌蛋白;成骨过程;新生血管生成;ECM合成。作者发现MSC细胞包含于Gli1+细胞中。MSC在纤维化前阶段功能发生重编程,获得这四种表型,促进纤维化进展。
作者接下来利用反转录病毒表达JAK2V617F突变体来验证该团队之前的发现,他们发现此突变是患者中最常见的突变。突变小鼠在24周后出现严重的纤维化。利用单细胞转录组技术分析该突变小鼠发现了与ThPO诱导BM纤维化模型一致的八种细胞亚型,MSC-1和MSC-2也是该突变小鼠纤维化的驱动细胞。在MSC-1和MSC-2细胞中,JAK2V617F可以诱导细胞向成纤维细胞和成骨细胞表型转换。
为了在人样本中验证这些发现,作者利用临床病人样本进行单细胞转录组分析。分析发现MSC细胞中与BM微环境维持和造血功能支持相关基因下调,细胞外基质表达明显上调。与动物模型一致,MSC中JAK-STAT和TGF-b通路明显上调,驱动纤维化进展。
作者在人样本以及小鼠模型中发现S100A8 / S100A9在非造血细胞中上调明显。已经有报道表明S100A8/S100A9可以作用在分泌细胞的附近,产生生物学效应。作者推测MSC上调S100A8/S100A9警报蛋白,影响邻近造血干细胞功能。
于是作者检测了Tasquinimod 在JAK2V617F突变小鼠中的作用。Tasquinimod可以结合S100A8/S100A9,阻止其与TLR4和RAGE受体结合。作者发现Tasquinimod可以改善骨髓增殖情况,明显降低纤维化程度,恢复BM结构。这些结果也表明了S100A8/S100A9在纤维化过程中起核心作用,S100A8/S100A9是骨髓纤维化极具潜力的治疗靶标。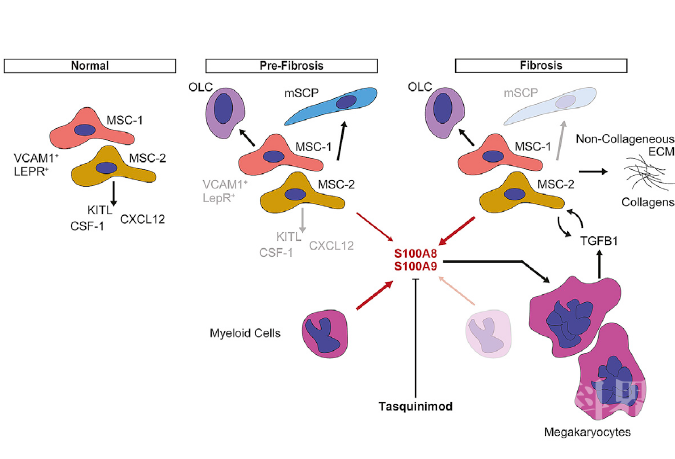
本研究利用小鼠模型和病人样本单细胞转录组分析揭示了纤维化前阶段 MSCs发生功能性重编程,驱动纤维化过程。切断MSC细胞作用于邻近造血干细胞的影响,阻碍警告蛋白复合体S100A8/S100A9的作用途径可以改善骨髓纤维化程度。
原文链接:
https://doi.org/10.1016/j.stem.2020.11.004
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652514161&idx=7&sn=c428d9183e2cbf07ebd690a349f93a39
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn