来源:植物生物学
近日,来自德国于利希研究中心兼科隆大学生物化学研究所的Pitter F. Huesgen教授与瑞典于默奥大学化学系Christiane Funk教授合作,在Journal of Experimental Botany发表了题为“FtsH12 abundance modulates chloroplastdevelopment in Arabidopsis thaliana”的研究论文。

本研究亮点:拟南芥金属蛋白酶FtsH12丰度的变化导致质体输入机制发生改变,进而影响功能性光合叶绿体的发育。
FtsH(Filamentation temperature-sensitive H)蛋白酶家族是包含AAA(与各种细胞活动相关的ATP酶)结构域和锌指蛋白酶结构域的膜结合蛋白酶,它广泛存在于真菌、动物和植物中。FtsH的N端含有一个或多个跨膜结构域使之结合在质膜上,而C端游离于细胞质。在光合生物中FtsH基因数目明显多于非光合生物,拟南芥中的FtsH家族主要包括12个FtsH蛋白和5个缺失锌指结构域的FtsH同源蛋白FtsHi,分别定位于叶绿体和线粒体。FtsH蛋白主要参与损伤蛋白降解以及逆境胁迫的响应过程。研究表明,FtsH1,2,5,8是构成FtsH复合体的主要成分,在植物光合作用中具有重要功能,主要参与光损伤D1蛋白的降解。除FTSHi3之外,FTSHi敲除突变体均是胚胎致死表型;FTSHi1、FTSHi4、FTSHi5突变植株的子叶、生长表型以及叶绿体超微结构均发生改变。
FtsH12是FTSH家族中最大的成员,FtsH12敲除突变体胚胎致死。免疫沉淀验证发现FtsH12能够与FtsHi1、FtsHi2、FtsHi4、FtsHi5以及NAD依赖的苹果酸脱氢酶(pdNAD-MDH)、YCF2形成一个异构2-MDa复合物。这种异构复合物与叶绿体内膜(TIC)转运子的20、56、100、214(YCF1)亚基形成的质体输入复合物相结合,并以其ATP酶亚基产生的拉力驱动蛋白输入。FtsH12驱动复合物任一亚基的敲除突变体都是胚胎致死,而TIC20、TIC56和TIC100的单个敲除突变体则表现为白化幼苗。因此,FtsH12是ATP驱动运动复合物的重要组成部分,而与其蛋白水解活性无关。然而,在禾本科植物中未发现FtsH12同源物与FtsHi的存在,因而FtsH12-FtsHi复合物和相互作用的TIC复合物对质体蛋白输入的重要性存在极大争议。此外,FtsH12的表达调控对植株所产生的影响到目前为止还未被研究。
本研究对FtsH12的表达和拓扑结构进行了鉴定,并对FtsH12不同表达水平的拟南芥株系表型、形态、蛋白质组和N端肽进行了分析。利用亚细胞分离技术与细胞器蛋白酶保护试验证实了FtsH12位于叶绿体内膜。叶绿体中FtsH12水平的降低导致植物表型和质体形态发生显著变化(图1)。另外,FtsH12不仅在叶绿体中表达,还可在根的质体和前质体中观察到FtsH12的存在。自身启动子驱动表达Myc-FtsH12,经研究分析表明其与FtsHi1、FtsHi2、FtsHi5和质体NAD-MDH互作形成异源异构复合物。
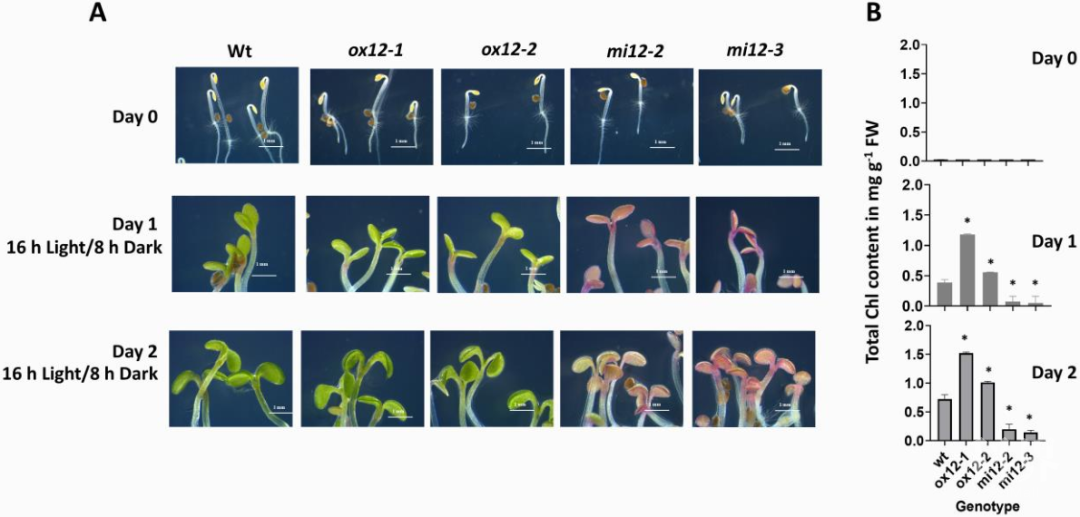
图1. WT,FtsH12过表达与下调表达幼苗的去黄化表型
幼苗中FtsH12水平的增加或降低可导致蛋白质组发生显著改变,包括质体蛋白输入机制的组成部分。当FtsH12-FtsHi复合物丰度降低时,TIC22-III蛋白反而在低水平FtsH12植物中积累。N末端富集分析进一步表明质体输入蛋白的正常蛋白水解过程与FtsH12丰度无关。总之,上述研究表明FtsH12显著影响幼苗发育,低水平FtsH12造成质体蛋白输入能力受限,从而导致幼苗叶绿体发育受阻。
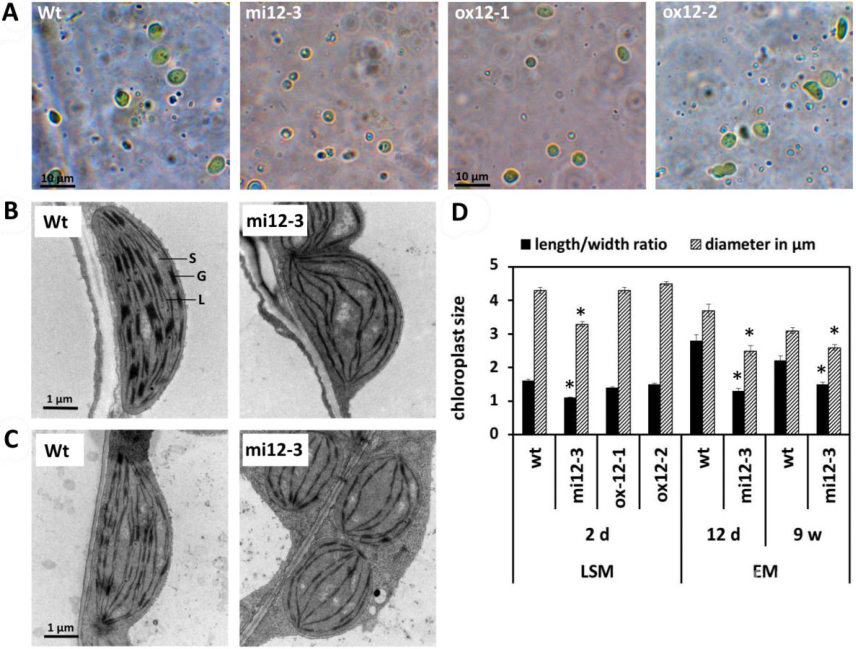
图2. FtsH12不同表达水平下幼苗叶绿体的大小和形态
来源:PlantBiotech 植物生物学
原文链接:http://mp.weixin.qq.com/s?__biz=MzI5NTk2MTcyOA==&mid=2247493079&idx=1&sn=baa983ac0ed4ecad0503ece178d90572
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn


