来源:BioArt植物
与动物不同,高等植物只能固着生长的特点决定了其能够根据复杂的环境条件不断地调整器官的发生和发育进程进而更好的生存下来。植物根系,尤其是侧根作为植物吸收水分、养分和应对胁迫的重要器官,在适应各种环境条件中起着至关重要的作用。与主根不同,植物的侧根是胚后器官,由主根的中柱鞘起始细胞起始。在侧根形成的过程中,侧根原基必须穿过三个不同的细胞层:内皮层、皮层和表皮。在植物中,生长素作为最重要的激素之一在侧根的起始和发育过程中起到十分重要的作用。过去对生长素调控侧根的研究主要集中在细胞核内的经典生长素信号通路,即生长素受体TIR1蛋白家族感知生长素并促进下游转录抑制子AUX/IAA蛋白的降解,从而释放ARF-LBDs转录调控模块调控侧根的发育 (Okushima et al., 2007, Plant Cell)。除经典的生长素信号通路外,是否还存在其它的重要生长素信号途径参与侧根的发生,多年来一直是悬而未解的问题。
近日,山东大学丁兆军教授团队在Molecular Plant在线发表了题为MPK14-mediated auxin signaling controls lateral root development via ERF13 regulated very-long-chain fatty acids (VLCFAs) biosynthesis的研究论文,揭示了MPK14介导生长素调控侧根发育的新机制。

丁兆军教授团队前期的研究工作发现,生长素能够激活MPK14的激酶活性并进一步磷酸化IAA33从而调控其蛋白稳定性,进而参与调控根尖干细胞的维持 (点击查看:山东大学丁兆军教授团队揭示生长素信号调控根尖干细胞稳态的新机制)。进一步的研究发现,MPK14能够正调控侧根的发育,MPK14功能缺失突变体mpk14具有侧根发育缺陷的表型。为了进一步探索MPK14参与生长素调控侧根发育的分子机制,该研究通过酵母双杂交筛选发现,MPK14能够与ETHYLENE RESPONSE FACTOR13 (ERF13)互作。并且发现生长素能够通过激活MPK14进而磷酸化ERF13诱导其蛋白的降解,解除ERF13对侧根发生的抑制。35S:ERF13:MYC过表达材料具有侧根突破显著减少的表型,并且该表型是由于侧根原基由IV期向V期转变受到抑制造成的。通过对ERF13下游调控基因的筛选发现,ERF13能够通过抑制3-ketoacyl-CoA synthase16(KCS16)基因的表达进而影响超长链脂肪酸(VLCFAs)的合成参与侧根的发育。并且发现VLCFAs能够影响侧根原基处皮层细胞壁中果胶的降解,从而影响了侧根原基由IV期向V期的转变。
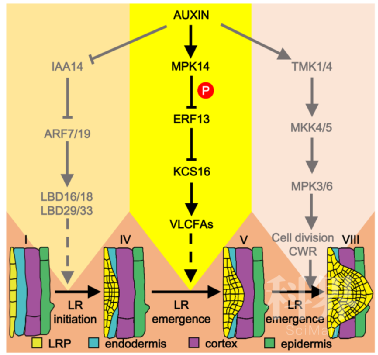
综上所述,该研究阐明了生长素通过激活MPK14激酶活性进而磷酸化ERF13,磷酸化的ERF13被26S蛋白酶体降解从而释放下游KCS16基因的表达促进VLCFAs的合成,VLCFAs进一步影响侧根原基处皮层细胞壁中果胶的降解,从而影响了侧根原基由IV期向V期的转变,进而影响的侧根的发育。该研究拓展了生长素调控侧根发育的分子途径,并且首次揭示了丝裂原激活蛋白激酶(MAPK)信号调控侧根发育详细的下游分子机制。该研究及最近报到的TMK1/4-MKK4/5-MPK3/6介导的非经典生长素调控的侧根发生途径(点击查看:PNAS | 福建农林大学徐通达课题组揭示生长素调控细胞分裂模式新机制),进一步丰富和完善了生长素调控侧根发育的分子调控网络。
丁兆军教授团队长期从事植物激素尤其是生长素如何整合内在的发育信号和外在的环境信号调控植物根可塑性生长发育的研究,近来取得一系列研究进展(Lv et al., 2020, EMBO J.; Kong et al.,2020, Cell Reports; Zhang et al., 2020, PloS Genet.; Jia et al., 2020, New Phytologist; Lv et al., 2020, JIPB.)。
山东大学已出站博士后吕丙盛博士为本论文的第一作者,丁兆军教授为通讯作者,山东农业大学张宪省教授团队也参与了该项研究。本研究得到了国家自然科学基金,山东省重大基础研究项目,中国博士后科学基金特别资助项目,面上项目和山东省博士后创新项目的资助。
参考文献:
1) Huang, R., Zheng, R., He, J., Zhou, Z., Wang, J., Xiong, Y., and Xu, T. (2019). Noncanonical auxin signaling regulates cell division pattern during lateral root development. Proc Natl Acad Sci USA 116:21285-21290.
2) Lv, B., Yu, Q., Liu, J., Wen, X., Yan, Z., Hu, K., Li, H., Kong, X., Li, C., Tian, H.,Ding Z*. (2020). Non-canonical AUX/IAA protein IAA33 competes with canonical AUX/IAA repressor IAA5 to negatively regulate auxin signaling. EMBO J 39:e101515.
3) Okushima, Y., Fukaki, H., Onoda, M., Theologis, A., and Tasaka, M. (2007). ARF7 and ARF19 regulate lateral root formation via direct activation of LBD/ASL genes in Arabidopsis. Plant Cell 19:118-130.
4) Kong X*, Zhang C, Zheng H, Sun M, Zhang F, Zhang M, Cui F, Lv D, Liu L, Guo S, Zhang Y, Yuan X, Zhao S, Tian H, Ding Z*. Antagonistic Interaction between Auxin and SA Signaling Pathways Regulates Bacterial Infection through Lateral Root in Arabidopsis. Cell Rep. 2020 Aug 25;32(8):108060.
5) Lv B, Hu K, Tian T, Wei K, Zhang F, Jia Y, Tian H, Ding Z*. The pre-mRNA splicing factor RDM16 regulates root stem cell maintenance in Arabidopsis. J Integr Plant Biol. 2020 Aug 13. doi: 10.1111/jipb.13006.
6) Jia Y, Kong X, Hu K, Cao M, Liu J, Ma C, Guo S, Yuan X, Zhao S, Robert HS, Li C, Tian H*, Ding Z*. PIFs coordinate shade avoidance by inhibiting auxin repressor ARF18 and metabolic regulator QQS. New Phytol. 2020 Jun 10. doi: 10.1111/nph.16732
7) Zhang F, Tao W, Sun R, Wang J, Li C, Kong X, Tian H, Ding Z*. PRH1 mediates ARF7-LBD dependent auxin signaling to regulate lateral root development in Arabidopsis thaliana. PLoS Genet. 2020 Feb 7;16(2):e1008044.
来源:bioartplants BioArt植物
原文链接:http://mp.weixin.qq.com/s?__biz=MzU3ODY3MDM0NA==&mid=2247500140&idx=1&sn=5f4e333870c7ed1545845d9b3ef45551
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



