过程热力学分析(thermodynamic analysis of process )是指化工热力学的一项研究内容,即应用热力学第一定律和第二定律分析化工过程,以确定在过程中有效能损失的数璜、分布和原因,目的在于了解过程中的能量利用情况和节约途径,为过程的优化和不同过程比较提供依据。有效能的损失,按原因可分为:(1)排出损失,这是生产中的泄漏和散热以及废弃物和未利用物料排出的损失;(2)不可逆损失,这是由压力差推动下的流体流动、浓度差推纨下的质量传递以及化学热差推动下的相变化和化学反应所引起的拫失。1
概 述热力学分析(thermodynamic analysis),又称第二定律分析(second-lawanalysis)或㶲分析(exergyanalysis),是应用热力学基本原理分析能量转换过程的有效性和合理性的一门实用性学科,它的基础是热力学第二定律,即过程不可逆原理的应用。
热力学第一定律是能量守恒定律,它无法回答为什么能源会匮乏的问题。热力学第二定律指出,实际过程是不可逆的,能量虽然在数量上守恒,但不同形式的能量的可转换性却是不守恒的,这就是说,能量存在质的差别。热力学分析以数量和质量(晶位)两个方面研究能量的转换过程,道出了用能过程的本质和节能的关键。
热力学分析的理论基础全部包含在经典热力学之中,但是在处理方法上有其特点,热力学分析特别强调要把系统放在给定的环境中考查,将系统和环境一并考虑。热力学分析通常研究实际的开式系统,而不是闭式循环。
早在19世纪末,热力学家J.W.Gibbs和工程热力学家G.Gouy及丸Stodola就分别提出了能量的可用性、能量相位以及损耗功等概念。20世纪30年代,美国工程热力学家J.H‘Keenan首次提出 availability 函数,德国的F.Bosnjakovic提出technische Arbeitfahigkeit 函数。50年代前南斯拉夫的Z.Rant首创exergy一词,得到了国际公认。这样,过程热力学分析逐渐形成了完整体系。70年代以来,能源问题受到举世瞩目,热力学分析成为开展节能研究的有力工具,在理论上更为完备,应用领域日益扩大,以动力、制冷等过程推广到所有化工过程、单元操作、太阳能及其它新能源利用等领域。热力学分析被认为是工程热力学在本世纪取得成就最大的一个分支。2
基本方法过程热力学分析就是用热力学方法对过程中能量转化、传递、使用和损失情况进行分析,揭示出能量消耗的大小、原因和部位,为改进过程,提高能量利用率指出方向和方法。
热力学分析方法有三种,能量衡算法、熵分析法、㶲分析法。
能量衡算法以热力学第一定律为基础,通过物料衡算、能量衡算求出过程总能量的利用率(代表第一定律的效率)。
能量损失与㶲损失 建立了㶲和㷻的概念后,我们对能量的守恒性和实际过程的不可逆性有了较深的认识。能量守恒是指在一切过程(无论可逆的还是不可逆的过程)中,㶲和㷻的总量保持恒定。若分别讨论㶲和㷻则只有在可逆过程中,两者才各自保持恒定;而在实际不可逆的过程中,都会导致㶲向㷻的转化。
能量损失与㶲损失在概念上是完全不同的。由于能量是守恒的,所以笼统地讲能量损失是违反热力学第定律的。通常讲的能量损失是指某个系统的㶲和㷻的总量损失,它是一种外部损失,又称排出损失,即通过各种途径散失和排放到环境中去的能量,如排出系统的废气、乏汽、冷却水、冷能水、废液、废渣等带走的能量、保温不良的热损失。
㶲损失包括两部分,内部损失和外部损失。内部损失是由系统内部各种不可逆因素造成的㶲损失。例如,直接接触式换热器或间壁式换热器的有温差△T的传热,吸收、精馏、萃取塔中上升和下降的两相流体之间有浓度差△c的传质,管道中、设备中有压差△p为推动力的流体流动(包括节流),在反应设备中进行的有化学位差△μ的化学反应过程。外部损失是通过各种途径散失和排放到环境的㶲损失,如废气、乏汽、冷却水、冷凝水、废液、废渣带走的炯、保温不良的炯损失。
工程上各种能源实际上就是㶲源,而环境介质中储存的大量能量都是不能利用的。有些人往往将能量的概念和㶲的概念等同起来,要注意两者的差异。3
熵分析法熵分析法是通过计算不可逆熵产量,以确定过程的损耗功和热力学效率。熵分析法的主要内容包括: ·
①确定出入系统的各种物流量、热流量和功流量,以及各物流的状态参数;
②确定物流的熵变和过程的损耗功、㶲损失;
③确定过程的热力学效率。
由不可逆因素引起的㶲损失就等于相应的㷻增量,所以㶲损失可以用两种方法计算,一种是㶲平衡法,另一种是㷻平衡法。由㶲平衡法计算㶲损失将在后面介绍,这里介绍用㷻平衡法计算㶲损失。
WL=ΔA0=T0ΔST
熵分析法的局限性是只能求出过程的不可逆㶲损失,而没有计算排出系统的物流㶲和能流㶲;也就是说,只能求出有效能的内部损失,不能求出有效能的外部损失。因此。不能确定排出物流㶲和能流㶲的可用性。以及由此而造成的㶲损失。熵分析法的局限性在㶲分析法中可以避免。
㶲分析法㶲分析法是通过㶲平衡确定过程的㶲损失和㶲效率。㶲分析法的主要内容有:
①确定出入系统的各种物流量、热流量和功流量,以及各物流的状态参数;
②由㶲平衡方程确定过程的㶲损失;
③确定热力学第二定律效率。
下面介绍怎样进行㶲平衡计算。考察右图所示的稳流过程,对该系统进行有效能衡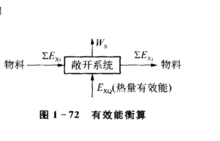 算。通常,位能、动能变化较小,可以忽略,对于可逆过程WL=0,有效能守恒
算。通常,位能、动能变化较小,可以忽略,对于可逆过程WL=0,有效能守恒
EXQ+ΣEXi入 = WS+ΣEXj出
式中,ΣEXi入为进入系统的物流㶲;ΣEXj出为流出系统的物流㶲;EXQ为进入系统的热流㶲。对于不可逆过程WL>0,㶲衡算式为
EXQ+ΣEXi入 = WS+ΣEXj出+WL3
过程热力学分析内容化工生产中,人们总是希望能够合理、充分的利用能源,提高能源的利用率,以获得更多的功。根据热力学的基本原理,阐述了理想功、损失功、有效能等一些基本概念和计算,以便评定实际生产过程的能量利用情况,我提高能量利用效率,改进生产提供一定的理论依据。
理想功理想功是指体系的状态变化完全按可逆过程进行时所表现出的功,即体系在做功过程中,在给定变化条件下所能够完成的最大功量,或在消耗功的过程中所需的最小功,对于非流动体系,理想功为
Wid =T0ΔS - ΔU - p0ΔV
式中Wid为理想功;T0为环境的绝对温度;ΔS和ΔU分别为体系的熵变和内能变化;p0是环境的压力;ΔV是体系的体积变化。
对于稳定流动过程,其理想功表达式为
Wid=T0ΔS- ΔH- ΔEk- ΔEp
其中ΔH为体系的焓变;ΔEk和ΔEp分别表示动能差和位能差。
在实际应用过程中,许多情况下动能差和位能差往往可忽略不计,于是理想功为
Wid =T0ΔS - ΔH
损失功体系在给定状态变化过程中所做的可逆功与其相应的实际过程所做的功之间的差值称为损失功。对于一个不可逆过程,损失功的计算公式为
WL=T0ΔST =T0(ΔS+ΔS0)
式中WL为损失功;ΔST为体系与环境的总熵变;ΔS0表示环境的熵变。根据热力学第二定律,一切自然过程都有ΔST≥0,因此WL≥0,这表明任何不可逆过程都有其代价,损失功是正值。
对于稳定流动过程,其损失功可表示为
WL=Wid - WF
其中Wid用上式计算;WF为实际功,计算公式为
WF=Q- ΔH- ΔEk- ΔEp
其中Q是相对体系而言的传热量。这样稳定流动过程的损失功便可表示为
WF=T0ΔS -Q4
过程热力学分析的表达式对于单一步骤过程,其损失功可直接应用式WL=Wid - WF计算。对于更为复杂的包括几个步骤的过程,则必须对每一个步骤分别进行损失功的计算。在此情况下,上式最好改写成下列形式:ΣWL=Wid - WF(式1)式中,累加号是指过程中所有步骤而言。式中各项要分别计算:
全过程的理想功Wid =T0ΔS - ΔH
每个步骤的损失功WL=T0ΔS - Q
过程的实际功WF=Q- ΔH- ΔEk- ΔEp
对于产生功的过程,最好将公式1写成下列形式
Wid =WF+ΣWL
上式表明,过程的理想功在数值上等于两部分功量之和,第一部分是过程的实际功WF,第二部分是变为不可利用的那部分功量即损失功ΣWL。既然是这样,理想功即为给定的状态变化中充其量所能得到的最大功,因此热力学效率ηt应为实际功对理想功之比值:
ηt = WF/Wid
对于接受功的过程,将公式1最好写成
WF=Wid -ΣWL
上式右边第一项是理想功,代表该过程在给定的状态变化中所需的最小功,第二项代表过程各个步骤由于不可逆性所引起的损失功。由此可见,对于接受功的过程,实际所需要的功量应大于理想功,于是,其热力学效率应为理想功对实际功之比:
ηt = Wid/ WF 5
本词条内容贡献者为:
陈红 - 副教授 - 西南大学