热力学原理是普通的规律。正因为它的普遍性,就不会具体化,就不能直接由此推算出具体体系的汽液平衡数据。反之,如果某一个具体体系的汽液平衡关系已经测出,则该特殊情况应该符合热力学的普遍规律。若两者不相符合,肯定可以认为是汽液平衡的实验数据不够正确,在测温、测压、组成分析或是否真正达到平衡等方面存在误差,必须进行检查并冉次进行汽液平衡的实验,直至两者符合后方能认可。这种用热力学原理来校核实验结果的可靠性的方法,称为汽液平衡数据的热力学一致性检验。
热力学平衡态如果系统中所有状态函数均不随时间而变化,则称系统处于热力学平衡态(thermodynamicequilibrium state)。热力学平衡态需要同时满足以下平衡。
1、热平衡 系统中各部分的温度相同。系统内部不存在热的传递。
2、力平衡 系统中各部分的压强相同。系统中没有不平衡的力存在。
3、相平衡 系统中相变达到平衡。系统中各相的组成和数量不变,即相与相之间不存在物质净的转移。
4、化学平衡 系统中化学反应达到平衡。系统中各物质的组成和数量不随时间而变化。
满足上述四种平衡是系统处于热力学平衡态的必要条件,一旦某一个平衡被打破.则系统的状态必然打破。1
热力学一致性检验的定性描述由于气液平衡仪器的应用不当或者组成的分析误差,及温度、压力的测量误差等原因,所得汽液平衡的数据往往不一定可靠,因此在应用已发表的数据时先用热力学一致性检验其可取性是十分重要的。
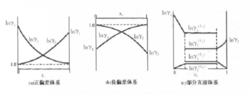
现在根据对二组分体系汽液平衡数据的热力学一致性作几点定性的描述。假设根据已测得的汽液平衡数据作出两条Inγi~Xi曲线图,即lnγ1~X1曲线与Inγ2~ X2曲线。 如果这套数据是热力学一致性的,则应该符合下列六条定性的规律:
(1)所有的数据点应落在光滑的曲线上,即应没有分散的数据点。如果有任何落在线外的点,则表示该数据点有误差。
(2) 当两个活度系数曲线都是以X为横坐标,则两条曲线的斜率的符号一定相反。如果X1=X2=0.5时,两条曲线的斜率应该互为相反数。
(3)如果两个端值相等,则中点值约为端值的1/4;如果端值不等,端值高的曲线的中点值低,而端值低的曲线的中点值高。
(4)如果在Inγi~Xi曲线上不出现最高点及最低点,则在整个范围内,两条曲线的斜率一定都是正的或都是负的;如果一曲线上出现极大值或极小值,则在另一曲线上在同一组成处必然出现极小值或极大值。
(5)如果lnγi~Xi曲线符van Laar方程,则以(Inγ1)0.5对(Inγ2)0.5作图时,应得一条直线。如不符合van Laar方程,则该线稍有曲变。
(6)在两条lnγi~Xi的曲线下面所包括的面积应该彼此相等。2
气液两相的平衡和转化对于具有相同成分及相同物理、化学性质的均匀物质部分我们叫作相。 自然界中许多物质都具有固、液、气三相。在一定的条件下,不同相之间可以相互转变,称为相变。根据相的定义,固体的不同晶体结构形态也属于不同的相,相互间也可以发生相变。近代研究物质表面层中电子状态的变化,也可以认为是一种相变。
1、 气化
物质由液态转变成气态的过程叫做气化,有蒸发和沸腾两种形式。蒸发是液体表面所发生的气化现象。开口杯中的水之所以会逐渐干掉,就是因为杯内的水不断蒸发成水蒸汽,而逸散到周围空间中去的缘故。影响蒸发快慢的重要因素是温度、蒸发表面和通风条件。温度越高蒸发越快,因此,把湿衣服放在炉子旁边要干得快些;液体表面越大,蒸发也越快,因此晒衣服时总要把它晾开;通风越好,使从液体表面蒸发出来的分子排走得越快,蒸发就越迅速。密闭容器中,蒸发速度越来越慢,最后达到饱和,气液两相处于平衡共存状态。
如果我们对液体继续加热,实验发现,当液体温度升高到某一数值时,液体内部产生大量气泡。气泡由液体内部上升到液面后,在液面破裂并放出大量蒸气,这种在液体表面和内部同时进行的剧烈气化的现象叫做沸腾,相应的温度称为沸点。由于沸腾是剧烈的气化过程,这时外界供给的热量全部用于液体的气化,温度停留在沸点不再上升,直到液体全部气化为止。
从分子运动论的观点来看,气化是液体分子变成蒸气分子的过程。分子要离开液面,就要克眼周围液体分子的吸引力而作功,这就要消耗能量。因而在蒸发过程中,只有动能较大的分子才能逸出液面,结果使留下的液体分子的平均动能变小,从而使液体温度下降。为了维持液体温度不变,就要从外界吸收热量。另一方面,在从液态分子转变为气态分子的过程中,分子之间的距离要增大,因而必须克服分子间的吸引力而作功,这也需要从外界吸收能量。这些因素合起来所需要从外界吸收的热量,就是物质的气化热。显然,温度较高时,分子热运动比较激烈,所需的气化热就较小。至于沸腾,情况和蒸发差不多,只是这时液体内部也产生气泡,因而大大增加了气体和液体之间的分界面。
当然,由于分子的热运动,在蒸发过程里,一方面固然有动能较大的分子逸出液面,另一方面也存在着蒸气分子不断返回液体的情况,这是一个动态过程。在通风比较好的条件下,蒸气分子不断被带走,蒸发的多,返回的少,所以蒸发进行得较快。但在密闭的情况下,最后总要达到在单位时间内进出液面的分子数相等的平衡状态。这时与液体保持动态平衡的蒸气就是饱和蒸气。在一定温度下,由于进出液面的分子数相等,饱和蒸气密度不变,因而饱和蒸气压不变。而随着温度升高,分子动能增大,液体中足以逸出液面的分子数增加,饱和蒸气密度变大,从而使得饱和蒸气压随温度的升高而变大。
2、液化
物质从气态转变成液态的过程叫作液化,也称凝结。液化是气化的反过程,随着温度的下降,饱和蒸气中的蒸气分子要凝结成液体,同时放出热量,使液体温度升高。单位质量的蒸气在凝结时放出的热量称为凝结热,数值上等于同温度的气化热。要使蒸气液化,也可用增加蒸气压的办法来实现。 但这是有条件的,需要在在临界温度T0之上,无论如何压缩气体也无法使气体液化。当原来已有液体存在时,降温或减压可以正常地液化气体。但在原来只有气态的情况下,蒸气的凝结往往需要有凝结核,否则即使蒸气压力实际上已大大超过它的饱和蒸气压,往往还不发生凝结现象,而形成过饱和状态。 凝结核是蒸气分子借以聚结成液滴的微粒,大多数是尘埃一类的东西,带电的粒子和离子也都是很好的凝结核。
3、气液两相图,克拉珀龙-克劳修斯方程
对于二氧化碳的等温线,该曲线把p-V图分成气相、液相、气液两相共存等三个区域,因而可认为二氧化碳的相图是气液两相图。 但由于在相变过程中,P、T存在着一定的函数关系,所以通常人们习惯用p-T图描写相变。 而且,由于在p-V图上,表示气液共存区的是一块面积,而在p-T图中, 表示气液共存区的只是一根曲线OC,因而用p-T图描写相变比用p-V图更方便。下图就称为气液两相图
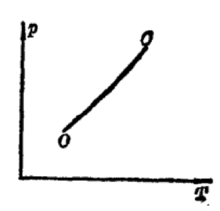
曲线OC称为气化曲线。曲线上的点是两相共存区,曲线的上方为液相区,下方为气相区。气化曲线的终点C就是临界点,对应的温度和压力就是临界温度Tc和临界压力Pc。易见,T>Tc的区域也是气相区域,气化曲线的终点O温度为T0,在温度低于T0时,气相只能与固相共存。3
本词条内容贡献者为:
张静 - 副教授 - 西南大学