来源:科研圈
《自然-通讯》上周发表的一篇论文Cryo-EM structure and polymorphism of Aβ amyloid fibrils purified from Alzheimer’s brain tissue报道了从阿尔茨海默病和脑淀粉样血管病患者脑组织分离的β淀粉样蛋白原纤维的结构。研究结果为理解阿尔茨海默病的结构基础提供了新认识,或有助于相关药物开发。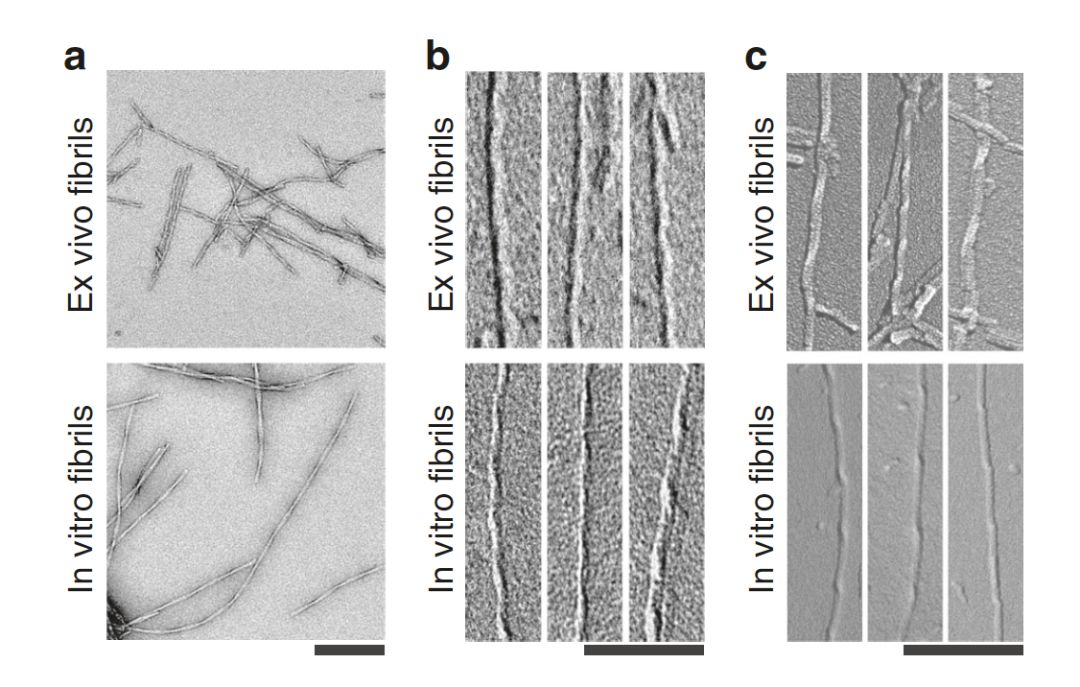
脑源性和实验室制备的β淀粉样蛋白原纤维的不同结构。| 来源:Kollmer et al.
阿尔茨海默病是一种进行性的神经退行性疾病,它的一大特征是β淀粉样蛋白原纤维在斑块和血管壁的沉积。虽然实验室制备的β淀粉样蛋白原纤维在结构上已经得到了很好的表征,但这些纤维在大脑中的结构一直知之甚少。
德国乌尔姆大学Marcus Fändrich和同事在三位阿尔茨海默病患者死后从他们大脑组织中纯化了β淀粉样蛋白原纤维,并用冷冻电子显微镜分析了其结构。作者在所有三名患者的样本中都发现了三种各不相同但结构相关的β淀粉样蛋白原纤维形态,并确定了其中一种形态的分子结构。出乎意料的是,脑源性原纤维的结构与实验室制备的β淀粉样蛋白原纤维的结构差异显著。比如,脑源性β淀粉样蛋白原纤维是右旋折叠,它们的肽折叠方式也与此前分析的原纤维折叠方式非常不同。
该结构突出了表征患者源淀粉样原纤维的重要性。此外,该研究还有助于理解阿尔茨海默病导致的突变对β淀粉样蛋白的影响,或有助于开发防止这类原纤维形成的药物。
© nature
Ncomms|doi:10.1038/s41467-019-12683-8
点击“阅读原文”阅读论文
Cryo-EM structure and polymorphism of Aβ amyloid fibrils purified from Alzheimer’s brain tissue
来源:keyanquan 科研圈
原文链接:http://mp.weixin.qq.com/s?__biz=MzA5NDkzNjIwMg==&mid=2651686935&idx=4&sn=9e7251a907196bd665423f5a56146bad&chksm=8bbe25f2bcc9ace461114b7e1a9b7c7b3eb88e618933c8971fd4009c228429e97f48c08811b3&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn