结构域是生物大分子中具有特异结构和独立功能的区域,特别指蛋白质中这样的区域。在球形蛋白中,结构域具有自己特定的三级结构,其功能不依赖于蛋白质分子中的其余部分,但是同一种蛋白质中不同结构域间常可通过不具二级结构的短序列连接起来。蛋白质分子中不同的结构域常由基因的不同外显子所编码。
结构域是介于二级和三级结构之间的一种结构层次,是蛋白质三级结构的基本结构单位。所谓结构域是指蛋白质中由不同二级结构和超二级结构组合而成的独立的稳定结构区域。结构域也是蛋白质功能单元。在多结构域蛋白质中,不同的结构域常常与不同的功能相联系。1
结构在蛋白质三级结构内的独立折叠单元。结构域通常都是几个超二级结构单元的组合至蛋白质多肽链在二级结构的基础上进一步卷曲折叠成几个相对独立的近似球形的组装体。
结构域(Structural Domain)是介于二级和三级结构之间的另一种结构层次。所谓结构域是指蛋白质亚基结构中明显分开的紧密球状结构区域,又称为辖区。多肽链首先是在某些区域相邻的氨基酸残基形成有规则的二级结构,然后,又由相邻的二级结构片段集装在一起形成超二级结构,在此基础上多肽链折叠成近似于球状的三级结构。对于较大的蛋白质分子或亚基,多肽链往往由两个或多个在空间上可明显区分的、相对独立的区域性结构缔合而成三级结构,这种相对独立的区域性结构就称为结构域。对于较小的蛋白质分子或亚基来说,结构域和它的三级结构往往是一个意思,也就是说这些蛋白质或亚基是单结构域。结构域自身是紧密装配的,但结构域与结构域之间关系松懈。结构域与结构域之间常常有一段长短不等的肽链相连,形成所谓铰链区。不同蛋白质分子中结构域的数目不同,同一蛋白质分子中的几个结构域彼此相似或很不相同。常见结构域的氨基酸残基数在100~400个之间,最小的结构域只有40~50个氨基酸残基,大的结构域可超过400个氨基酸残基。
分类为了研究蛋白质分子结构的基本规律,人们用不同的方法从不同的角度对已知的蛋白质结构进行分类,有些是基于生物功能,有些是基于结构自身,有些是将二者结合在一起进行分类研究。例如,锌金属蛋白酶是一类可催化肽链内部肽键水解的肽链内切酶,尽管所属的各个亚家族成员的整体空间结构差异显著,但催化活性部位的结构非常类似,故将它们归属于一类蛋白。
然而,最为人们熟悉的还是M.Levitt和C.Chothia对蛋白质结构进行的分类。此方法认为二级结构的组合构成了大多数结构域结构的核心,并据此把蛋白质结构分为四类:α型、β型、α / β型以及其它类型的结构域结构。α型结构域结构主要由α-螺旋所构成,例如肌红蛋白的结构等。β型结构域结构主要由反平行的卜回折所构成,通常是两个卜回折相互包裹在一起,例如质体兰素的结构等。α / β型结构域结构则是由α-螺旋所包裹的以平行β-链为主的;β-α-β花样所构成的,例如丙糖磷酸异构酶、葡萄糖异构酶催化结构域的结构等。还有一些蛋白质是由不连续的α-和β-花样组合而成,并且通常在由α-螺旋包裹的结构域的一部分形成一个小的反平行β-回折,这些结构可以认为属于第四类,例如某些核酸酶的结构等。此外还有一些小的蛋白质,它们富含二硫键或金属离子,形成一个特殊的种类,这些蛋白质的结构似乎在很大程度上受金属离子或二硫桥的影响,所以看起来比常规的蛋白质显得无序。
类型有:α-螺旋型;α/β型;全β-折叠型;无规卷型。
性质又称基元。蛋白质分子的一种折叠单位,是较大的蛋白质分子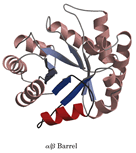 或亚基三维折叠中的一个层次或一种相对独立的三维实体。一条长链多肽链最后一步折叠就是结构域缔合(association),而成一个有活性的蛋白质分子或亚基。在一级(维)结构中的氨基酸序列的某些区域相邻的氨基酸残基形成有规则的二级(维)结构(如α-螺旋、β-折叠、β-转角和无规卷曲等);然后再把相邻的二级结构片段集装在一起,形成超二级结构;在此基础上,多肽链再进一步折叠,或为近乎球状的三维(级)结构而成(一个)结构域。对于一个较大球状蛋白质分子来说,一条庞大的多肽链往往由两个或两个以上相对独立的三维实体缔合而成三维结构体。最常见的结构域约含有100~200个氨基酸残基,一般至少40个、多的可至400个以上;对于较小的蛋白质分子或亚基,“结构域”和“三级结构”往往是一个概念,也就是说,这些蛋白质是属于单结构域分子(如卵溶菌酶等)。从功能角度看,很多属于多结构域的酶蛋白,其活性中心都位于结构域之间,这是基于:(1)通过结构域容易构建具有特定三维排布的活性中心;(2)结构域之间常只有一段肽链相连,使域间容易发生相对运动,这将有利于活性中心结合底物或施加应力,有利于别构中心结合调节物和发生别构效应,以利于酶对反应的催化。
或亚基三维折叠中的一个层次或一种相对独立的三维实体。一条长链多肽链最后一步折叠就是结构域缔合(association),而成一个有活性的蛋白质分子或亚基。在一级(维)结构中的氨基酸序列的某些区域相邻的氨基酸残基形成有规则的二级(维)结构(如α-螺旋、β-折叠、β-转角和无规卷曲等);然后再把相邻的二级结构片段集装在一起,形成超二级结构;在此基础上,多肽链再进一步折叠,或为近乎球状的三维(级)结构而成(一个)结构域。对于一个较大球状蛋白质分子来说,一条庞大的多肽链往往由两个或两个以上相对独立的三维实体缔合而成三维结构体。最常见的结构域约含有100~200个氨基酸残基,一般至少40个、多的可至400个以上;对于较小的蛋白质分子或亚基,“结构域”和“三级结构”往往是一个概念,也就是说,这些蛋白质是属于单结构域分子(如卵溶菌酶等)。从功能角度看,很多属于多结构域的酶蛋白,其活性中心都位于结构域之间,这是基于:(1)通过结构域容易构建具有特定三维排布的活性中心;(2)结构域之间常只有一段肽链相连,使域间容易发生相对运动,这将有利于活性中心结合底物或施加应力,有利于别构中心结合调节物和发生别构效应,以利于酶对反应的催化。
结构域实质上是二级结构的组合体,充当三级结构的构件。每个结构域分别代表一种功能。
有些球形蛋白的一条肽链,或以共价键相连的两条或多条肽链在空间结构上可以区分为若干个球状的子结构,其中的每一个球状子结构就被称为一个结构域。同一个蛋白的各个结构域之间是以肽链相互链接的,而链接两个结构域的绝大多数都是单股肽链,只有在极个别的情况下会有少数的双股肽链联系不同的结构域。在X-射线衍射实验绘制的电子密度图中,可以清楚地看到有些球状蛋白地的部存在一些裂隙,这些裂隙就是各个结构域之间的链接部分,结构域之间的链接虽然是松散的,但他们仍然属于同一条肽链,靠肽链链接这一点和蛋白质的各个亚基之间依靠非键相互作用维系结构有着本质的区别。
结构域在空间上具有临近相关性即在一级结构上相互临近的氨基酸残基,在结构域的三维空间结构上也相互临近,在一级结构上相互远离的氨基酸残基,在结构域的空间结构上也相互远离,甚至分别属于不同的结构域。
结构域与蛋白质完成生理功能有着密切的关系,有时几个结构域共同完成一项生理功能,有时一个结构域就可以独立完成一项生理功能,但是一个结构不完整的结构域是不可能产生生理功能的。因此结构域是蛋白质生理功能的结构基础,但必须指出的是,虽然结构域与蛋白质的功能关系密切,但是结构域和功能域的概念并不相同。
举例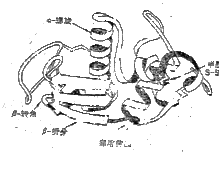 乳酸脱氢酶有2个结构域免疫球蛋白(Ig)有12个结构域[VL(轻链的变区)、CL(轻链的恒区)、VH(重链的变区)、CH1(重链的恒区1)、CH2(重链的恒区2)、CH3(重链的恒区3)各2个]。其中可变区决定了Ig的特异性,而Ig的其它生物学性质,如免疫原性、穿过胎盘、结合补体(或巨噬细胞的吸附)等作用则由恒区决定。
乳酸脱氢酶有2个结构域免疫球蛋白(Ig)有12个结构域[VL(轻链的变区)、CL(轻链的恒区)、VH(重链的变区)、CH1(重链的恒区1)、CH2(重链的恒区2)、CH3(重链的恒区3)各2个]。其中可变区决定了Ig的特异性,而Ig的其它生物学性质,如免疫原性、穿过胎盘、结合补体(或巨噬细胞的吸附)等作用则由恒区决定。
形成:结构域之间的结构比较松懈,常形成裂隙或洞穴裂隙内有许多非极性氨基酸残基,因而是疏水的,不允许水分子进入,但能容钠蛋白质的辅基或酶的底物分子等。
意义:蛋白质的活性部位或变构结构部位多位于裂隙处。由于结构域之间连接的柔韧性,每个结构域可进行较大幅度的相对运动,使裂隙开放或关闭,便于蛋白质分子与其他分子之间的相互作用,故这些部位往往是活性中心所在的部位,或是变构物结合的部位。
区别模体(mo tif)即超二级结构,简言之,就是二级结构有规律的组合。例如螺旋-环-螺旋,贝塔折叠的组合、阿而法螺旋组合等。再比如亮氨酸拉链、锌指结构都是典型的模体,它们执行一定的功能,即模体既是结构的单位,又是功能单位,他们可直接作为结构域和三级结构的建筑块。某些蛋白质因子与DNA大沟结合的部位靠的就是某些特异的模体。 结构域(domain)是指在较大的蛋白质分子中形成的某些在空间上可以辨别的结构,往往是球状压缩区或纤维状压缩区。它们也既是结构单位,又是功能单位。例如免疫球蛋白的功能区就是结构域。显然模体与结构域是不同的概念。
tif)即超二级结构,简言之,就是二级结构有规律的组合。例如螺旋-环-螺旋,贝塔折叠的组合、阿而法螺旋组合等。再比如亮氨酸拉链、锌指结构都是典型的模体,它们执行一定的功能,即模体既是结构的单位,又是功能单位,他们可直接作为结构域和三级结构的建筑块。某些蛋白质因子与DNA大沟结合的部位靠的就是某些特异的模体。 结构域(domain)是指在较大的蛋白质分子中形成的某些在空间上可以辨别的结构,往往是球状压缩区或纤维状压缩区。它们也既是结构单位,又是功能单位。例如免疫球蛋白的功能区就是结构域。显然模体与结构域是不同的概念。
本词条内容贡献者为:
魏大勇 - 副教授 - 西南大学