来源:BioArt
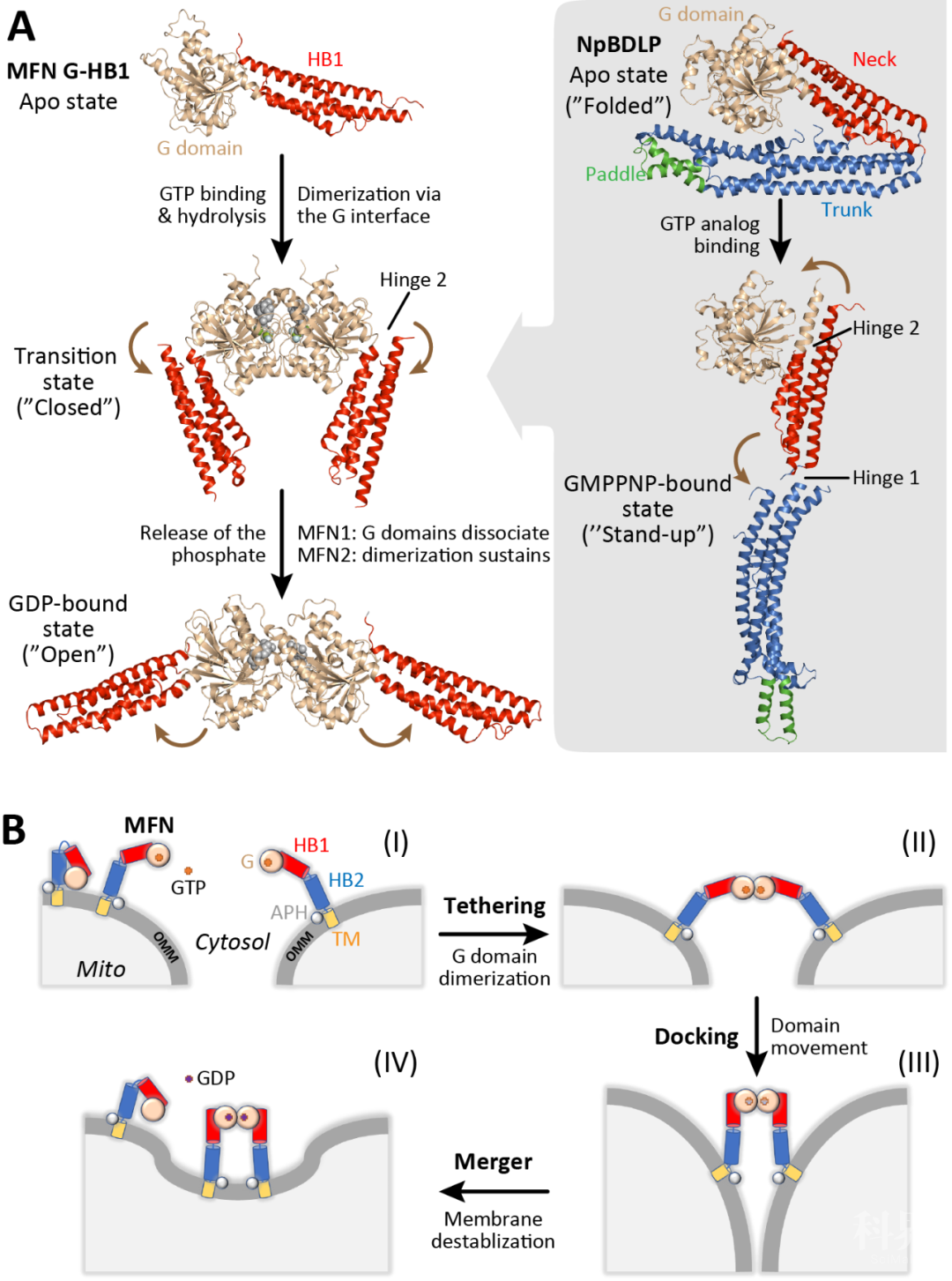
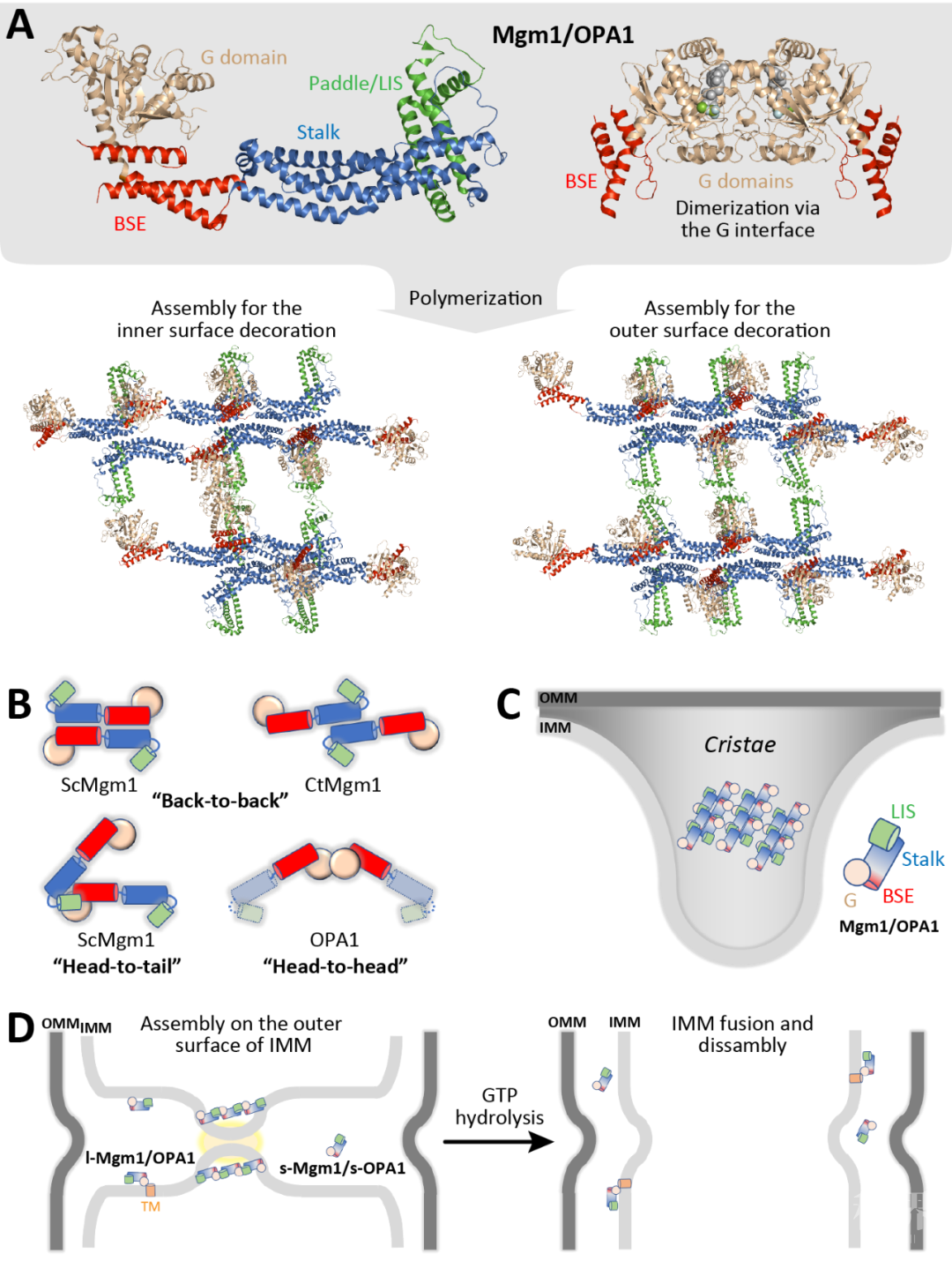
前言在绝大多数真核细胞中,线粒体不断进行着分裂(fission)和融合(fusion)以应对细胞的生理需求和外部环境的改变(图1)。线粒体动态平衡的失调会影响它的正常生理功能,并导致一系列人类疾病多种神经退行性疾病,代谢疾病和恶性肿瘤等的发生。图1:能量工厂的融合之路。艺术模拟图,李家馨作品。 膜融合反应频繁出现在多种不同的细胞生命活动中,具有重要的生物学意义。【参见“生物膜的分分合合 ”生物物理学会报道】与此前被广泛研究的异源融合(如囊泡与靶膜的融合或病毒与宿主细胞膜的融合)不同,线粒体的融合属于同源融合,即参与反应的两侧膜是同样的膜。线粒体的融合包含两个步骤,即由MFN介导的外膜融合和由OPA1介导的内膜融合。由于相关蛋白质机器结构信息的缺乏,线粒体融合的机制一直不甚明确。近日,中科院生物物理所胡俊杰研究员和中山大学高嵩研究员应邀在Trendsin Cell Biology杂志上发表了题为Mitochondrial Fusion:The Machineries In and Out 的综述文章。文章总结了线粒体融合相关蛋白质机器的最新前沿研究进展及其所揭示的可能的融合机制,讨论了线粒体融合研究对其他发动蛋白(dynamin)认知的启示,并分析了线粒体内外融合蛋白突变分别导致遗传性神经疾病的分子机理。 1. 介导线粒体融合的蛋白质机器线粒体融合会提升细胞氧化磷酸化的水平,并有助于线粒体DNA的损伤修复。介导线粒体外膜融合的基因mitofusin(哺乳动物包含MFN1和MFN2两个同源基因,酵母中为单一的Fzo1)和介导内膜融合的OPA1(Opticatrophy 1)在二十世纪九十年代末期被陆续发现。然而,这些蛋白的性质(多聚、膜锚定)对研究它们的结构造成了很大困难。此前唯一的进展出现在2004年,线粒体外膜融合蛋白C端的一小段螺旋在变复性后形成了反向的螺旋卷曲【1】。这一同源性相互作用被看作线粒体外膜融合前的拴连机制,并风靡线粒体领域多年。近年来,多项关于MFN和OPA1结构研究的突破为线粒体融合机制解析带来了新的契机和思路,极大拓展了人们对这一基本细胞生命活动的认识。 2. 线粒体融合蛋白与发动蛋白dynamin的结构关联线粒体内外膜融合的分子机器均属于发动蛋白(dynamin)超家族成员【2】。dynamin超家族成员是一类介导膜塑形的多结构域GTP酶,包含一个GTP酶结构域,以及一个或多个螺旋结构域(图2)。与经典的小G蛋白(如Ras,Rab等)不同,dynamin超家族成员的GTP水解激活是依靠GTP酶结构域的二聚化完成。介导膜分裂和膜融合的dynamin家族成员(fission dynamins and fusion dynamins)具有不同的特性。dynamin、MxA、DNM1L等fission dynamins能够形成螺旋型的多聚体,包裹住目的膜,并使之管状化(tubulation)继而断裂。而fusion dynamins——包括MFN和介导内质网融合的ATL在内——则表现出另一种结构特性。这种特性保证了在融合的初始阶段,MFN和ATL可以通过某种方式将不同的线粒体或内质网栓连并拉到足够近的距离。另一方面,线粒体的内膜融合并不需要经过该步骤。这一点也为以下事实所反映:OPA1作为功能上的fusiondynamin,却具备fissiondynamin的结构域分布。从2010年开始的近7年时间内,dynamin家族蛋白的结构陆续被报道[3-7],但MFN和OPA1的结构一直未被成功解析。图2:dynamin家族成员的结构。(A)结构域分布示意图。(B)晶体结构对比。 3.MFN的结构与线粒体外膜融合MFN介导的线粒体外膜融合包含栓连(tethering)、贴靠(docking)和合并(merger)三个连续的步骤。高嵩团队和胡俊杰团队分别报道了MFN1片段(包含GTP酶结构域和一个螺旋结构域HB1/HD1)在不同GTP水解状态下的晶体结构[8-10]。MFN1在GTP水解过程中发生局部和整体的构象变化,并通过GTP酶结构域的二聚化来介导线粒体外膜的栓连(图3)。这种这种可逆的栓连方式可以避免线粒体的过度聚集。MFN的结构域运动方式可能与细菌的dynamin-like protein(BDLP)非常类似[11, 12],后者的结构特点为推测全长MFN的作用机制提供了重要线索。MFN全长的结构目前仍然未知,因此线粒体外膜最终融合的机制并不十分明确。MFN1和MFN2虽然结构和功能类似,但在调控方式和疾病相关性方面存在一定差异。高嵩团队近期研究发现灵长类 MFN2具有比MFN1更强的膜栓连效率[13]。另一方面,MFN1和MFN2可以通过GTP酶结构域形成异源二聚体。因此,MFN1和MFN2的比例会在很大程度上影响线粒体融合的过程。图3:MFN介导线粒体外膜融合的机制。(A)MFN1/2的结构及其与BDLP的对比。(B)线粒体外膜融合过程示意图。 4. OPA1/Mgm1的结构与线粒体内膜融合线粒体内膜融合比起外膜融合更为复杂。在外膜融合后,内膜融合必须快速高效的跟进完成。此外,内膜融合蛋白OPA1/Mgm1需要发生部分水解,成为整合型(L-form)和可溶性(S-form)两种形式,才能顺利完成融合反应,而且OPA1还需参与嵴的塑形。近期,胡俊杰团队报道了酿酒酵母的Mgm1的晶体结构及OPA1的MGD(最小GTP酶结构域)结构[14, 15],而德国的Daumke团队报道了一种嗜热真菌的Mgm1的电镜和晶体结构[16],中科院生物物理研究所的孙飞团队则报道了OPA1的两种多聚状态结构[17]。这些结构中,内膜融合蛋白呈现了“头对头”、“头对尾”、“背靠背”等三种交互的界面,因此能以多种方式组装。其中,头对头和背靠背界面可能参与了嵴的塑形,而融合则可能以来头对尾的串联形成小规模的螺旋,从而在每侧的膜上形成较不稳定的膜凸起,当两侧的膜凸起对接时,内膜融合即可完成(图4)。图4:OPA1/Mgm1介导线粒体外膜融合的机制。(A)OPA1/Mgm1的结构。(B)Mgm1的聚合方式。(C)嵴塑形的机制。(D)线粒体内膜融合过程示意图。 5. 线粒体融合研究的启示MFN2和OPA1的疾病突变多集中于GTP酶结构域和HB1结构域中,主要影响的功能包括核苷酸的结合与水解,GTP酶结构域二聚化的形成,G和HB1之间摆动的构象调控,以及对蛋白正确折叠的维持。根据现有的融合模型,MFN2突变大多直接影响了线粒体外膜的拴连和融合,而OPA1突变则更多的影响了嵴塑形或蛋白稳定,从而间接破坏内膜融合。有趣的是,MFN2的一些突变并未降低其核苷酸结合或水解的能力,有些反而有上升,说明这些GTP酶活性的精密调控是保证线粒体正常动态所必需的。线粒体融合蛋白的研究帮助我们提炼出鉴别发动蛋白究竟是介导融合还是裂解的规律:融合类发动蛋白更多依赖二聚化,而裂解类发动蛋白倾向于形成多聚体;融合类发动蛋白基本都为整合膜蛋白,而裂解类发动蛋白则多为外周膜蛋白。 总结与展望 结构分析在线粒体融合机制研究中起到关键作用。然而,一些关键的结构尚未被解析,如MFN的HB2以及全长结构,OPA1的全长结构以及在GTP水解过程中的结构变化。除了传统的结构解析手段,cryo-ET和FRET等生物物理技术也将在线粒体融合研究中起到重要作用。MFN和OPA1的全长分子如何工作,其介导的内外膜融合如何协调发生也是领域关注的重点。最终,内外膜融合机器的体外共重组,即双层膜的体外重组的实现,虽然极具挑战,将成为线粒体融合研究的终极目标。


来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652508697&idx=7&sn=10dcd6929c8fd1fa4925c11062e4591a
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



