来源:BioArt
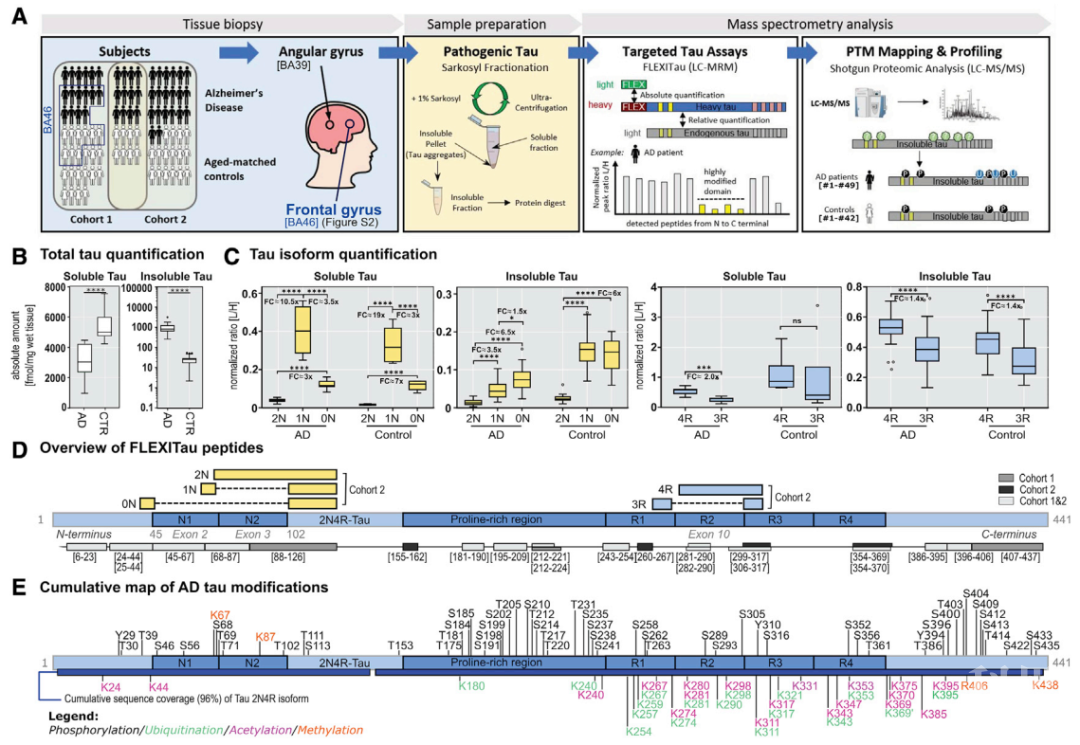
阿尔兹海默症(Alzheimer’s disease, AD)是众所周知的严重威胁患者生存质量的神经退行性疾病,其病理特征主要为β-淀粉样蛋白(Aβ)的淀粉样斑块(plaques)和微管结合蛋白Tau形成的神经纤维缠结(neurofilament tangle, NFT)。尽管多项研究已证实Aβ的重要性,但截至目前,针对Aβ治疗策略的研究已陷入僵局。因此,越来越多的研究人员把目光集中在Tau。在AD疾病发展过程中,病理性神经元纤维Tau聚集体显示出朊病毒样特征,即起始聚集的“种子”Tau(seeding)可以在相邻神经元间传播【1,2】。先前有报道指出,当存在高分子量的寡聚过度磷酸化的Tau(AT8和AT100)时,脑裂解液中的Tau会发生聚集【3】。当然,除磷酸化外,也有相当一部分研究提出Tau还受到其他多种蛋白翻译后修饰(post-translational modifications, PTM),从而影响NFT的形成。免疫组化一直是鉴定和定量Tau蛋白形式的主力军,尽管此类基于抗体的方法易于实施并能够提供半定量信息,但终究无法准确地检测定量变化或确定PTM化学计量。考虑到PTM可以显著改变蛋白质的功能和毒性,剖析人类AD中病理性Tau的特定分子特征对于早期诊断和机制指导疗法的发展至关重要。2020年11月13日,来自哈佛医学院的Judith A. Steen课题组在Cell杂志上发表了题为“Tau PTM Profiles Identify Patient Heterogeneity and Stages of Alzheimer’s Disease”的文章,在这项研究中,作者利用先前开发的一种靶向的高通量定量质谱的方法—FLEXITau(full-length expressed stable isotope-labeled Tau),对91例人体组织(尸检)进行了定量和定性的蛋白质谱分析,表征和绘制了AD中病理性Tau的PTM图谱,并确定与tau蛋白的“seeding”潜能相关的PTM最小集合及其在NFT形成过程中的作用。这些定性和定量数据阐述了tau蛋白的相关PTM在疾病进展中的关键作用,并为治疗性抗体,成像试剂和AD诊断的关键靶标的开发提供了关键的靶点。首先,作者对来自49例AD患者和42例对照的顶叶缔合皮层(BA39)灰质中可溶于/不溶于十二烷基肌氨酸钠(Sarkosyl)的Tau进行绝对定量分析。结果发现,与对照组相比,AD患者的可溶性Tau总量较低且不溶性Tau(构成NFT的主要tau成分)高约100倍。在可溶和不溶性级分中0N,1N,2N,3R和4R Tau异构体特异性肽的相对量也在两组间显示出明显差异,且0N和4R亚型在AD患者中更易于聚集(见下图1)。重要的是,在所有样品的88个氨基酸残基上作者共鉴定出95个不同的PTM,并分析出它们所在患者中的频率,这是了解不同PTM病理和人群异质性的关键。图1,工作流程示意图及Tau的亚型分布和PTM分子表征接下来,作者对两个队列中鉴定的Tau PTM进行无监督分层聚类分析并使用PLS-DA方法来确认究竟哪些可量化的PTM在AD和对照组的区分更为重要。作者在AD患者所在的分别对应临床Braak分期的V和VI阶段的聚类b和c中,观察到一些较高频率的PTM特定组合,且在两个聚类中多为相似,这一结果在很大程度上反映了PTM与AD疾病进展的相关性,鉴于疾不同阶段的PTM谱存在明显差异,提示早期干预和晚期治疗AD可能需要不同的靶点药物。值得注意的是,在两个队列中,富含脯氨酸的区域(Proline rich region, PRR)和C端肽以及微管结合域(microtubule binding domain, MBD)未修饰肽的丰度呈负相关关系,PRR和C端肽磷酸化程度的增加可能涉及中和MBD结构域中的正电荷从而促进聚集事件的发生。此外,作者发现未修饰的C端肽在AD中的丰度低,且存在一个对照簇中C端肽完全未修饰,提示C端肽的修饰可能是衰老和AD病理过程中的早期事件。有趣的是,来自AD和对照组的十二烷基肌氨酸钠溶液不可溶的Tau,在纤维化过程中存在持续性且有秩序的PTM发生顺序。为了进一步地识别与Tau蛋白“seeding”活动相关的PTM,作者根据分子量及“seeding”能力的不同,讲tau蛋白归于以下四类,包括(1)十二烷基肌氨酸钠可溶性Tau(以下简称为S-Tau,不可溶的简称为I-Tau);(2)通过MC1抗体免疫亲和柱分离的可溶性Tau(以下简称为MC1-Tau);(3)可溶性低分子量Tau(LMW, 50 kDa);(4)寡聚高分子量Tau(HMW, > 120 kDa),并将这四种Tau级分数据与不溶性Tau数据进行比较。结果显示,在具有“播种”能力的HMW和I-Tau以及不具备“播种”能力的LMW和S-Tau之间的PTM图谱有所不同,泛素化修饰似乎对于具有“播种”能力的Tau而言是独有的。此外,结果表明随着Tau颗粒度从LMW至HMW和MC1-Tau逐渐增长至十二烷基肌氨酸钠溶液不可溶的纤维化Tau,PTM也逐渐发生累积,这些数据与“seeding”能力研究结果一起提供了形成tau蛋白寡聚体所需的最小PTM集合。最后,作者根据病理性Tau的定性及MS定量数据中观察到的最显著特征,提出Tau纤维化形成的可能模型。随着疾病的进展,不同阶段所观察到的PTM数量和位点的占有率逐渐增加,例如上述提到的簇a中临床Braak阶段最低仅为0–I,仅显示Tau的磷酸化且PRR结构域占据三个位点;在簇d中,受试者的临床Braak阶段为III-IV,在PRR结构域额外增加六个磷酸化位点和C端一个磷酸化位点;而在对应临床Braak阶段为V或VI的簇b中,MBD结构域多个位置出现乙酰化和泛素化修饰;在对应临床Braak阶段为VI的簇c中,PTM从N端到C端整体呈增加趋势。总体而言,这些分析表明Tau 0N和4R亚型易于发生聚集,PTM逐步级联,包括C端裂解和PRR带负电的磷酸化,随即在MBD上发生的乙酰化和泛素化修饰完成电荷中和,是Tau纤维化形成和AD疾病进展的关键步骤。图2,基于化学计量PTM分析提出的Tau纤维化形成模型总的来说,这项研究为人类疾病中病理性Tau亚型的分子特征提供了前所未有的定量和定性视图,这对于合理设计抗体和小分子治疗剂以及早期的临床诊断而言至关重要。参考文献
1, de Calignon, A., Polydoro, M., Sua ´rez-Calvet, M., William, C.,Adamowicz, D.H., Kopeikina, K.J., Pitstick, R., Sahara, N., Ashe, K.H.,Carlson, G.A., et al. (2012). Propagation of tau pathology in a model of earlyAlzheimer’s disease. Neuron 73, 685 697.
2, Walker, L.C., Diamond, M.I., Duff, K.E., and Hyman, B.T. (2013).Mechanisms of protein seeding in neurodegenerative diseases. JAMA Neurol. 70,304–310.
3, Takeda, S., Wegmann, S., Cho, H., DeVos, S.L., Commins, C., Roe, A.D.,Nicholls, S.B., Carlson, G.A., Pitstick, R., Nobuhara, C.K., et al. (2015).Neuronal uptake and propagation of a rare phosphorylated high-molecular-weighttau derived from Alzheimer’s disease brain. Nat. Commun. 6, 8490.




来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652508434&idx=4&sn=e796c7f7e5f71a1c1bb7e83938c61de5
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn