来源:研之成理
背景介绍:尽管免疫疗法成功地实现了10-30%的受试者的长期生存,但对大多数癌症患者来说,免疫疗法仍然无效。因此,许多研究正在进行中,以确定新的方法来增强这种免疫检查点疗法(该疗法的目的是阻断抑制T细胞检查点信号通路的蛋白质,从而使这些免疫细胞释放到靶向癌细胞的目标上)。本文亮点:本文表明,抑制PCSK9(一种调节胆固醇代谢的关键蛋白)可以通过一种独立于PCSK9胆固醇调节功能的机制来增强肿瘤对免疫检查点疗法的反应。
敲除小鼠癌细胞中的PCSK9基因可以显著削弱或阻止其在小鼠体内的生长,其方式依赖于细胞毒性T细胞。它还增强了针对检查点蛋白PD1的免疫治疗的疗效。
此外,临床认可的PCSK9中和抗体与抗PD1治疗协同抑制小鼠肿瘤模型中的肿瘤生长。通过基因缺失或使用PCSK9抗体抑制PCSK9可增加肿瘤细胞表面主要组织相容性蛋白Ⅰ类(MHC-I)蛋白的表达,促进细胞毒性T细胞的瘤内浸润。
从机制上讲,作者发现PCSK9可以通过与MHCI的物理结合以及促进其在溶酶体中的重新定位和降解来破坏MHCI在细胞表面的循环。总之,这些结果表明,抑制PCSK9是增强癌症免疫检查点治疗的一个有希望的方法。图文解析为了评估PCSK9对肿瘤生长的影响,作者使用CRISPR-Cas9技术敲除了4个小鼠恶性肿瘤细胞系(B16F10、4T1、MC38和CT26)中的PCSK9基因。为了确定免疫系统的参与,作者将pcsk9缺陷和载体控制4T1和B16F10肿瘤细胞接种到T细胞、B细胞和自然杀伤细胞缺陷的NCG小鼠中。
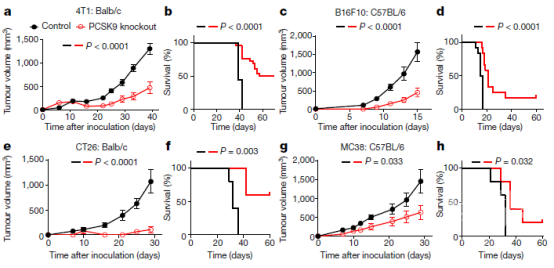
图1、PCSK9缺失会降低同基因小鼠的肿瘤生长。
将大约1x105个载体对照和相同数量的不同类型的pcsk9敲除小鼠肿瘤细胞皮下接种到同基因小鼠中,监测肿瘤形成情况。监测肿瘤大小和总生存率。a, b, 4T1乳腺癌系,在Balb/c小鼠中生长。c, d, B16F10黑素瘤系,在C57BL/6小鼠中生长。e, f, CT26结肠癌系,在Balb/c小鼠中生长。g, h, MC38结肠癌株,在C57BL/6小鼠中生长。为了评估PCSK9缺陷是否能与免疫检查点阻断治疗协同,作者使用小鼠抗PD1免疫检查点抑制剂,在接种PCSK9缺陷的B16F10、MC38、4T1或CT26肿瘤细胞的同基因小鼠中进行肿瘤生长延迟实验。
图2 抑制PCSK9克服肿瘤对抗PD1治疗的耐药性。a-c,在同基因小鼠中用抗PD1抗体治疗媒介控制和PCSK9敲除B16F10黑色素瘤。a、实验方案;b,肿瘤生长曲线;c,总生存率。在同基因小鼠中用抗PD1抗体治疗载体控制和PCSK9基因敲除MC38结肠癌。d、实验方案;e,肿瘤生长曲线;f,总生存率。抗PCSK9抗体和抗PD1抗体联合治疗MC38结肠癌。g、实验方案;h,肿瘤生长曲线;i,总生存率。接下来,作者尝试通过免疫荧光染色和流式细胞术定量对照组和pcsk9缺陷B16F10肿瘤中的免疫效应细胞。免疫荧光染色显示,PCSK9缺失导致肿瘤内CD45+白细胞和CD8+细胞的整体浸润增加。特别令人感兴趣的是,CD8+细胞在对照组肿瘤中大部分仍位于外周,但在pcsk9缺失的B16F10肿瘤中移至肿瘤细胞丰富的区域。
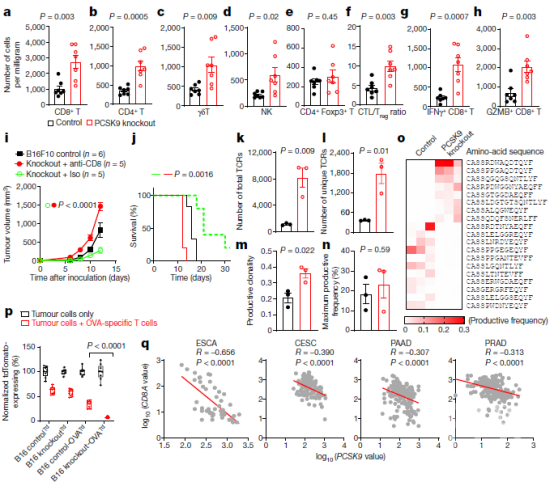
图3 PCSK9的缺失增强了肿瘤内T细胞的浸润。a-e,通过流式细胞仪测定的载体对照和PCSK9基因敲除B16F10肿瘤组织中每毫克肿瘤组织中各种免疫效应细胞的定量评估。f、 对照组和PCSK9基因敲除B16F10肿瘤中CD8+细胞毒性T淋巴细胞(ctl)与CD4+Foxp3+Treg细胞的比率。g、h,对照组或PCSK9基因敲除肿瘤组织中每毫克肿瘤组织中浸润IFN-γ+CD8+T细胞(g)和GZMB+CD8+T细胞(h)的平均数量。i、j,在缺乏CD8+T细胞的C57BL/6小鼠中,对照组和PCSK9基因敲除B16F10肿瘤细胞的肿瘤生长(i)和宿主存活率(j)。用TCR-βCDR3测序法,从对照组和PCSK9基因敲除肿瘤(o)和PCSK9基因敲除肿瘤(o)和PCSK9基因敲除肿瘤中最常见的5%的TCR的ko、总TCRs(k)、唯一TCRs(l)、生产克隆性(m)、最大生产频率(n)和热图。p、定量评估活体对照或PCSK9基因敲除B16F10-Td番茄(Td)肿瘤细胞与激活的OVA特异性T细胞孵育24小时后剩余的部分。q、食管癌(ESCA,47例)、宫颈鳞癌和宫颈腺癌(CESC,112例)、胰腺癌(PAAD,173例)和前列腺癌(PRAD,313例)中pcsk9mrna与CD8A呈负相关。接下来,作者重点研究了CTL介导的PCSK9缺陷肿瘤细胞杀伤增强的分子机制。由于PCSK9在调控细胞表面蛋白(如LDLR17、32、33)水平方面的已知作用,推测PCSK9缺陷可能影响肿瘤细胞表面抗原提呈。事实上,与对照的B16F10卵母细胞相比,IFN-min刺激、pcsk9缺失、B16F10卵母细胞表面的H2-Kb MHC I分子结合SIINFEKL的染色明显增强。因此,PCSK9对MHCI的肽抗原表达有很强的影响。进一步检测了敲除PCSK9对体内生长的B16F10肿瘤细胞表面H2b MHC I同种异体抗原水平的影响。
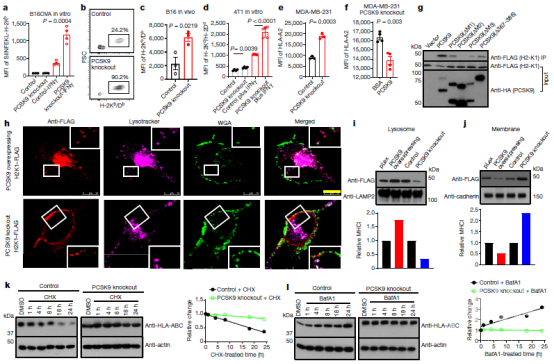
图4、PCSK9促进溶酶体介导的肿瘤细胞MHCI降解。a、对照组和PCSK9基因敲除B16F10细胞中SIINFEKL H-2Kb水平的定量评估。b,c,流式细胞术估计皮下生长的对照和PCSK9缺陷B16F10细胞表面H-2Kb/Db水平。d、组织培养对照和PCSK9缺陷4T1细胞表面mhci水平的定量评估。e、PCSK9基因缺陷对对照细胞和PCSK9基因敲除MDA-MB-231细胞表面HLA-A2表达的影响。f、外源性PCSK9蛋白对MDA-MB-231 PCSK9敲除细胞表面HLA-A2降解的影响。g、小鼠PCSK9和H2-K1在标记H2-K1联合血凝素(HA)标记全长PCSK9或PCSK9的293T细胞中的相互作用。h、PCSK9促进了H2-K1向溶酶体的迁移。MHCI(H2-K1标志)在PCSK9(PCSK9-HA)过度表达或PCSK9基因敲除B16f10细胞中分布的典型荧光共聚焦图像。i、j,上部分,western blot定量分析PCSK9过度表达和PCSK9敲除B16F10细胞的溶酶体(i)和质膜(j)部分中的H2-K1标志。底部,MHCI(H2-K1标志)表达水平的定量估计。k、左图:用放线菌酮(CHX,k)或巴非霉素A1(BafA1,l)处理的载体对照和PCSK9基因敲除MDA-MB-231细胞中HLA-ABC表达的免疫印迹分析。右图,基于免疫印迹分析的HLA-ABC水平定量估计。







来源:rationalscience 研之成理
原文链接:http://mp.weixin.qq.com/s?__biz=MzUxMDMzODg2Ng==&mid=2247546140&idx=4&sn=6ebdc9cca32f1204e7a9688e4e14ac02
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn