来源:BioArt
超重和肥胖的发展趋势在中西方世界中愈演愈烈,而全球(特别是中国)由肥胖引发的慢性代谢性疾病发病数量逐年攀升,社会医疗资源的投入不断增加,造成了严重的公共健康危机和社会经济负担。
脂肪组织是人体内重要的代谢组织,不仅是体内储存能量物质的场所,而且还是重要的内分泌组织(如分泌Adiponectin、Leptin等脂肪因子)、炎症调节和器官保护组织,并在机体物质和能量稳态中起到至关重要的调控作用。过度摄入的能量物质的储存造成脂肪组织扩张,脂肪致病性扩张(Pathological Expansion of Adipose Tissue)通常伴随着脂肪组织中炎性免疫细胞(如巨噬细胞)的积累,以及高水平慢性炎症的发生,这些被认为是导致肥胖相关代谢性疾病(如胰岛素抵抗、糖尿病)的主要原因之一【1】。因此,深入理解肥胖条件下脂肪组织中巨噬细胞累积和慢性炎症发生发展的机制,对于肥胖相关代谢性疾病的临床治疗和药物研发都具有非常重要的意义。
以往对于肥胖脂肪组织炎症的研究都专注于探索脂肪细胞或免疫细胞的作用,而基质细胞(Stromal cells)在该过程中功能,则一直不为人们所知。PDGFRβ+细胞是一种围绕血管内皮细胞存在的血管周细胞(Perivascular cells,或mural cells),具有多潜能干细胞属性,白色脂肪中的PDGFRβ+细胞被认为是脂肪前体细胞(Preadipocytes),成年小鼠腹腔脂肪组织中的PDGFRβ+细胞在高脂饮食(High fat diet, HFD)诱导的肥胖条件下,可以分化成为白色脂肪细胞【2】;通过特异性诱导成体小鼠PDGFRβ+细胞中Pparg的表达,促进肥胖小鼠脂肪细胞新生,可以在不改变肥胖程度的情况下,显著降低脂肪中炎症水平和纤维化程度,有效缓解功能紊乱,进而改善肥胖引起的胰岛素抵抗等代谢综合征【3】。
利用单细胞RNA测序技术分析出小鼠腹腔脂肪中PDGFRβ+细胞的异质性,发现该细胞可分成两种基因表达谱以及功能上都差别显著的两种细胞亚群,其中一个亚群是可分化成脂肪细胞的前体细胞(Adipocyte progenitor cells, APCs),而另一个细胞亚群不具有分化成脂肪细胞的能力,而表达相对较高水平的炎症和纤维化相关的基因,因而被称为Fibro-inflammatory progenitors(FIPs)【4】。
2020年11月2日,来自美国得州大学西南医学中心Touchstone糖尿病研究所Rana K. Gupta团队在Nature Metabolism上发表了题为:Perivascular mesenchymal cells control adipose-tissue macrophage accrual in obesity的研究论文。首次揭示了脂肪组组织PDGFRβ+细胞在调控肥胖脂肪组织的炎症反应和炎性免疫细胞累积中的重要功能和机制。 在本项研究中,研究人员发现:FIPs,而非APCs,对HFD刺激反应迅速,短达1天的HFD即可诱导FIPs中其主要炎性细胞因子(如Ccl2、Csf2、Cxcl10等)的表达,显示该细胞是脂肪组织中对能量过度摄入的早期响应者(之一);
在本项研究中,研究人员发现:FIPs,而非APCs,对HFD刺激反应迅速,短达1天的HFD即可诱导FIPs中其主要炎性细胞因子(如Ccl2、Csf2、Cxcl10等)的表达,显示该细胞是脂肪组织中对能量过度摄入的早期响应者(之一);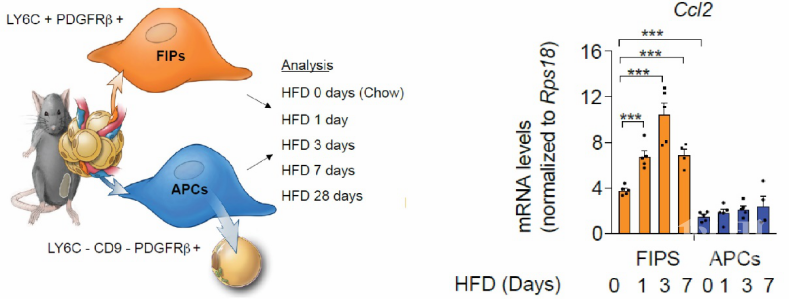 进一步的研究发现, TLR4-IKKβ-NFκB信号通路调控了FIPs受LPS或HFD诱导激活的炎性反应,参与介导了肥胖脂肪中炎症的发生以及炎性巨噬细胞的累积,特异性诱导敲除成年小鼠PDGFRβ+细胞内Tlr4基因,可以有效降低肥胖脂肪的炎症水平和巨噬细胞累积。
进一步的研究发现, TLR4-IKKβ-NFκB信号通路调控了FIPs受LPS或HFD诱导激活的炎性反应,参与介导了肥胖脂肪中炎症的发生以及炎性巨噬细胞的累积,特异性诱导敲除成年小鼠PDGFRβ+细胞内Tlr4基因,可以有效降低肥胖脂肪的炎症水平和巨噬细胞累积。 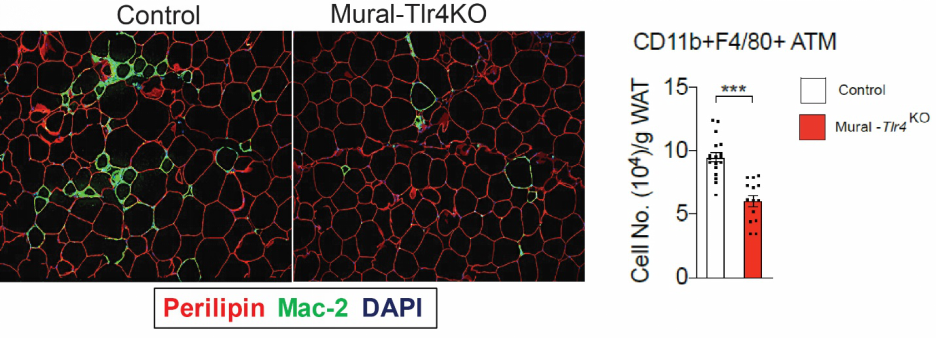 锌指蛋白Zfp423通常在成熟脂肪细胞或PDGFRβ+细胞中特异性表达,Zfp423的高表达被认为是脂肪前体细胞分化成脂肪细胞的标志之一【5】。FIPs中Zfp423表达水平显著低于APCs,提示该蛋白可能对FIPs的细胞属性具有抑制作用。研究人员发现,FIPs中Zfp423的表达在HFD或LPS处理后,都出现明显降低,进一步提示该蛋白参与调控了FIPs的炎症激活。利用rtTA-TRE小鼠模型,在Doxycycline特异性诱导PDGFRβ+细胞中Zfp423高表达后,FIPs受LPS或HFD引发的炎症反应被显著抑制,同时肥胖脂肪中的炎性巨噬细胞累积和炎症水平明显降低,缓解肥胖造成的脂肪供能紊乱。另一方面,诱导敲除PDGFRβ+细胞中Zfp423基因后,FIPs中的炎症反应能力显著增强,肥胖脂肪组织炎症水平和炎性巨噬细胞累积增多,从而促进了脂肪组织功能紊乱及胰岛素抵抗。
锌指蛋白Zfp423通常在成熟脂肪细胞或PDGFRβ+细胞中特异性表达,Zfp423的高表达被认为是脂肪前体细胞分化成脂肪细胞的标志之一【5】。FIPs中Zfp423表达水平显著低于APCs,提示该蛋白可能对FIPs的细胞属性具有抑制作用。研究人员发现,FIPs中Zfp423的表达在HFD或LPS处理后,都出现明显降低,进一步提示该蛋白参与调控了FIPs的炎症激活。利用rtTA-TRE小鼠模型,在Doxycycline特异性诱导PDGFRβ+细胞中Zfp423高表达后,FIPs受LPS或HFD引发的炎症反应被显著抑制,同时肥胖脂肪中的炎性巨噬细胞累积和炎症水平明显降低,缓解肥胖造成的脂肪供能紊乱。另一方面,诱导敲除PDGFRβ+细胞中Zfp423基因后,FIPs中的炎症反应能力显著增强,肥胖脂肪组织炎症水平和炎性巨噬细胞累积增多,从而促进了脂肪组织功能紊乱及胰岛素抵抗。
进一步研究发现,Zfp423通过作用于TLR4-IKKβ-NFκB信号通路的激活而抑制FIPs的炎症反应。Zfp423可以与NuRD复合体中关键蛋白RBAP48直接相互作用,介导NuRD复合体对NFκB主要组分p65蛋白的去乙酰化,同时阻碍了CBP/p300与p65的结合,从而降低了NFκB的转录活性, 抑制FIPs中炎症发生。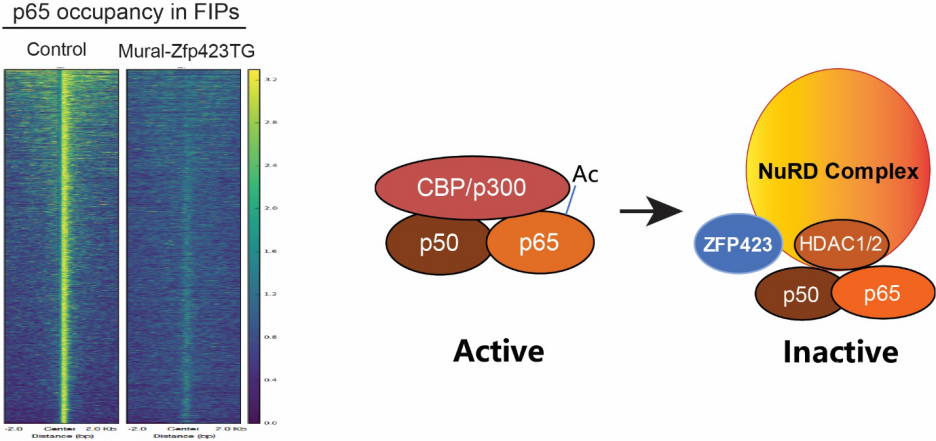 本项研究工作,不仅阐释了白色脂肪组织PDGFRβ+细胞中FIPs亚群在肥胖引起的慢性代谢性炎症和炎性免疫细胞累积中的重要功能,而且揭示了Zfp423蛋白在该细胞介导的脂肪炎症中的作用和分子机制,同时为通过调控FIPs细胞功能治疗肥胖及肥胖相关代谢性疾病提供理论支持。
本项研究工作,不仅阐释了白色脂肪组织PDGFRβ+细胞中FIPs亚群在肥胖引起的慢性代谢性炎症和炎性免疫细胞累积中的重要功能,而且揭示了Zfp423蛋白在该细胞介导的脂肪炎症中的作用和分子机制,同时为通过调控FIPs细胞功能治疗肥胖及肥胖相关代谢性疾病提供理论支持。
该部分工作由Dr. Gupta实验室博士后闪波和邵孟乐共同完成,为本文的共同第一作者,Rana K. Gupta教授为本文通讯作者。Touchstone 糖尿病研究所的张倩彬和安宇也对本工作做出突出贡献。
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652506221&idx=5&sn=02aa6dbf4e2f48654ca5a3ce9e3de85b&chksm=84e19bd9b39612cf32b0ce2a248da413541d14602d9d104838361009f9e0945d02670f8feadb&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn