来源:精准医学与蛋白组学
景杰学术/解读
弓形虫(Toxoplasma gondii)是一种能够感染所有温血动物的细胞内寄生虫,它所引起弓形虫病是世界上最普遍的人畜共患病之一。弓形虫主要侵入有核细胞,直接造成大量细胞溶解和组织功能障碍,因此给免疫系统受损的病人和接受免疫抑制治疗的病人带来巨大威胁。此外,弓形虫还能穿过胎盘屏障,严重威胁孕妇和新生儿健康。早期研究发现,蛋白质翻译后修饰(PTM)广泛存在于弓形虫体内,通过调控蛋白质的结构和功能影响弓形虫的增殖,运动和致病力。
2019年11月,沈阳农业大学陈启军教授课题组在蛋白质组学Top期刊Molecular & Cellular Proteomics上以封面文章的形式在线发表了题为Global lysine crotonylation and 2-hydroxyisobutyrylation in phenotypically different Toxoplasma gondii parasites的论文。作者利用两种具有不同增殖模式和致病性的弓形虫虫株(RH和ME49),绘制出迄今为止最全面的弓形虫赖氨酸巴豆酰化和2-羟基异丁酰化修饰图谱。研究者发现致病力强、繁殖快的弓形虫虫株(RH)发生修饰的水平明显高于致病力弱、繁殖慢的弓形虫虫株(ME49),提示蛋白质翻译后修饰在虫株致病力调控中发挥着重要作用。该研究不仅加深了研究者对人畜共患弓形虫病分子调控机制的理解,并且为寻找更好的疾病控制新工具提供有价值的资源。景杰生物为巴豆酰化和2-羟基异丁酰化修饰的检测提供了技术支持。

结果
1弓形虫两种不同表型虫株蛋白质组学的定量差异分析
在RH和ME49虫株中,作者分别鉴定出3527和3238个蛋白质,其中可定量蛋白质2855个(图1B)。两种虫株差异表达的蛋白质主要位于细胞核、细胞质、质膜和线粒体(图1D和1E)。其中RH虫株中上调的蛋白质具有转移酶和氧化还原酶活性,主要富集于内质网;而ME49株中上调的蛋白质更加多样化,涉及蛋白质二聚化活性和有机氮生物合成过程(1C)。

图1、两种弓形虫虫株蛋白质组学的定量差异分析
2弓形虫两种不同表型虫株巴豆酰化和2-羟基异丁酰化修饰丰度及亚细胞定位分析
作者利用两种酰化修饰泛抗体对两种虫株的总蛋白质进行Western blot实验,发现两种虫株中均存在丰富的巴豆酰化和2-羟基异丁酰化修饰,并且2-羟基异丁酰化修饰丰度高于巴豆酰化修饰(图2A)。免疫荧光分析表明2-羟基异丁酰化修饰蛋白质广泛分布于两种虫株的多个细胞区域,而巴豆酰化修饰蛋白质则主要集中于细胞核及核周围 (图2B)。 同时,作者在基于质谱的两种虫株巴豆酰化修饰和2-羟基异丁酰化修饰研究中得到了相同的结论(图2C)。
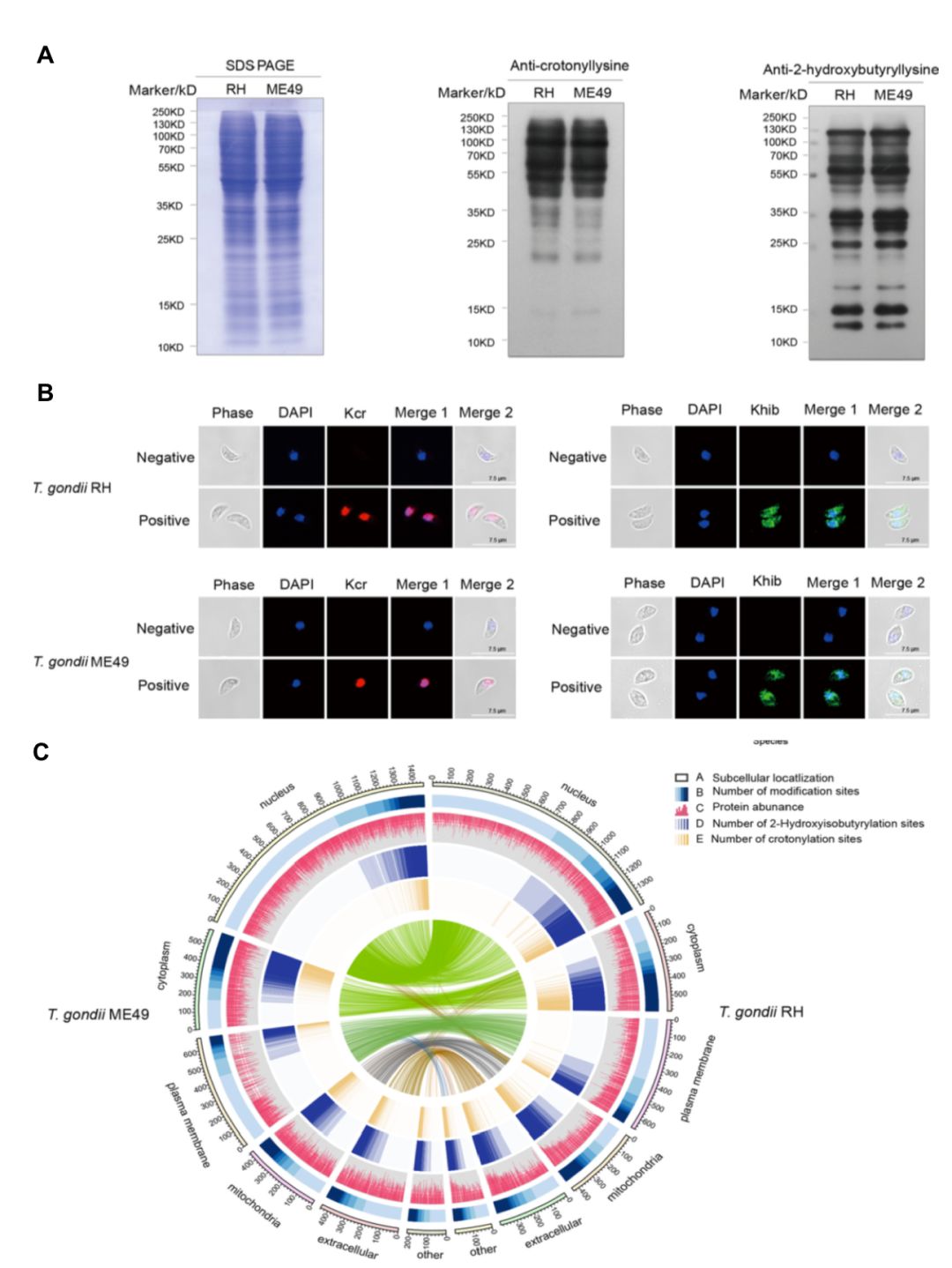
图2、两种弓形虫巴豆酰化和2-羟基异丁酰化修饰丰度及亚细胞定位分析
3弓形虫两种不同表型虫株的巴豆酰化和2-羟基异丁酰化的定量差异分析
研究者在两种虫株(RH/ME49)中一共检定量到2598个巴豆酰化修饰位点,对应744个蛋白质,以及6753个2-羟基异丁酰化修饰位点,对应1349个蛋白质。亚细胞定位分析显示差异修饰蛋白质大部分位于除质膜以外的亚细胞结构上(图3A)。KOG分析显示两个虫株的两种修饰有差异的蛋白质主要集中于核糖体结构、蛋白质合成,蛋白质翻译后修饰以及分子伴侣等类别(图3B)。KEGG通路富集分析结果显示差异修饰蛋白质主要富集于细胞质和核糖体通路,可能参与调节tRNA氨酰化、化合物代谢和生物合成过程(图3C)。作者对比了发生在两种虫株中的2-羟基异丁基化修饰蛋白质,发现在RH株特异的修饰蛋白参与脂肪酸降解和过氧化物酶体的形成,而ME49株特异的修饰蛋白质更多的参与到碳固定途径中。作者分析了被巴豆酰化和2-羟基异丁基化修饰的参与糖酵解/糖异生和三羧酸循环的调控酶,其中有17种参与糖酵解/糖异生的酶和7种参与三羧酸循环的酶被差异修饰,更为重要的是,作者发现多种三羧酸循环中的限速酶被修饰,如己糖激酶、6-磷酸果糖激酶、丙酮酸激酶和柠檬酸合酶I,这些限速酶参与了一系列的能量代谢过程,并且多数发生在RH株中,提示两种虫株糖代谢的差异可能与2-羟基异丁基化修饰有关,从而影响了虫株的繁殖速度。
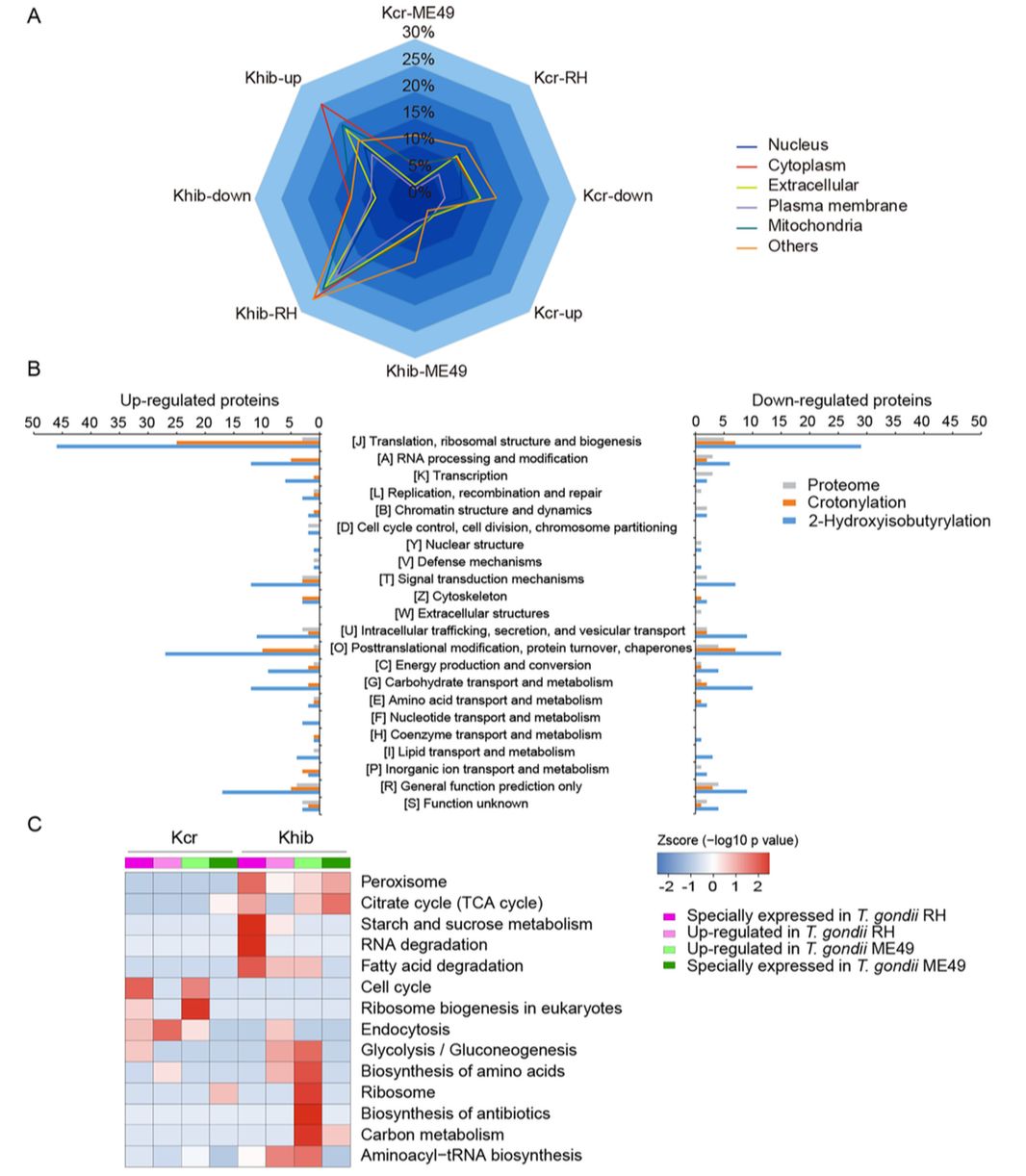
图3、两种弓形虫虫株的巴豆酰化和2-羟基异丁酰化的定量差异分析
4巴豆酰化和2-羟基异丁酰化修饰在弓形虫表观遗传调控中发挥作用
组蛋白翻译后修饰是表观遗传学研究主要方向之一,在调控基因转录和沉默中起关键作用。在本研究中,作者发现弓形虫组蛋白上17个位点发生巴豆酰化修饰,37个位点发生2-羟基异丁酰化修饰,相对于组蛋白上的其他蛋白质翻译后修饰,2-羟基异丁酰化修饰的丰度较高,而且其中5个位点(H3K57, H3K80, H3K123, H4K32,H4K80 )在人,小鼠,水稻中也高度保守,提示2-羟基异丁酰化修饰在弓形虫表观遗传调控中发挥着重要的作用。同时,作者总结发现H3K24, H4K32, H3K57, H2AzK10, H2AzK18, H2BaK100 和H2BaK112 上可同时发生巴豆酰化,2-羟基异丁酰化修饰或乙酰化等三种以上的修饰类型,提示这些位点上的修饰之间存在交互作用。另外,许多组蛋白修饰酶也发生巴豆酰化和2-羟基异丁基化修饰,包括精氨酸甲基转移酶家族(PRMT),组蛋白去乙酰化酶(HDAC2)和组蛋白赖氨酸乙酰转移酶MYST-A。
5巴豆酰化修饰和2-羟基异丁酰化修饰在弓形虫入侵过程中发挥重要作用
研究结果显示,在两种不同表型弓形虫中与入侵相关的蛋白质上共鉴定到70个各自特异的巴豆酰化和2-羟基异丁酰化修饰位点,如棒状体,微线体和致密颗粒等,其中在RH株中检测到61个(87.14%)位点。在这61个位点中,有52个位点(85.25%)发生了2-羟基异丁基化修饰,表明2-羟基异丁基化修饰可能参与弓形虫对宿主细胞的快速侵袭。同时,作者发现ROM4有3个位点发生2-羟基异丁基化修饰,提示2-羟基异丁基化修饰可能参与调控ROM4活性,从而促进弓形虫快速入侵(图4)。
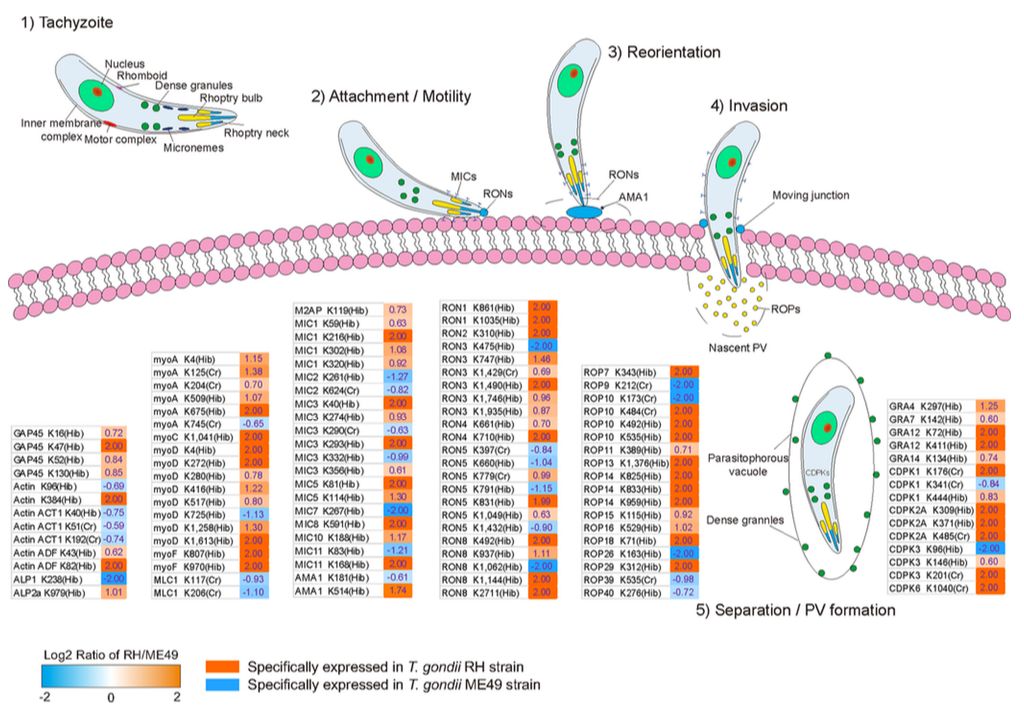
图4、侵染相关蛋白质巴豆酰化和2-羟基异丁酰化修饰
综上所述,作者首次绘制了弓形虫赖氨酸巴豆酰化和2-羟基异丁酰化的修饰图谱,从定型和定量两个角度全面阐述了两种不同表型弓形虫发育的特性,尤其在表观遗传及宿主入侵等方面的深入分析,为阐明弓形虫生物学特征,寻找疾病控制新工具提供有价值的资源。
参考文献
Deqi Yin, et al., 2019, Global lysine crotonylation and 2-hydroxyisobutyrylation in phenotypically different Toxoplasma gondii parasites. Molecular & Cellular Proteomics.
来源:ptm-biolab 精准医学与蛋白组学
原文链接:http://mp.weixin.qq.com/s?__biz=MjM5NDM5NjQxOA==&mid=2650445652&idx=1&sn=2402c8388a928cf02d1eb47c5386752c&chksm=be86573989f1de2fcde45dfd41e915fd1192e24833c33318ae06dc1f17b65281ea4a7564d3d3&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

