2020年10月8日,国家蛋白质科学研究(上海)设施用户中科院生物物理所高璞课题组和邓红雨课题组合作在PNAS上发表题为Molecular mechanism underlying selective inhibition of mRNA nuclear export by herpesvirus protein ORF10的研究工作,该研究综合运用生物化学、结构生物学及细胞生物学手段,解析了γ疱疹病毒ORF10与宿主mRNA转运复合物Rae1-Nup98的互作细节,确认了ORF10的RNA结合能力及其重要功能,并揭示了ORF10选择性抑制mRNA出核转运的作用机理。
病毒在与宿主长期的博弈过程中,进化出了多种机制来对抗和逃避宿主的抗病毒反应。其中,通过干预宿主的mRNA出核转运过程,进而阻止宿主细胞建立合适的抗病毒环境,是其中的一个重要策略。比如,甲型流感病毒NS1蛋白和水疱性口炎病毒的M蛋白均被发现可以广谱抑制宿主mRNA出核转运。2016年的一项研究发现,γ疱疹病毒(如卡波西肉瘤相关病毒KSHV和鼠γ疱疹病毒MHV68)编码的ORF10蛋白,可以通过与宿主mRNA转运复合物Rae1-Nup98相互作用,特异性抑制部分宿主mRNA的出核转运。值得一提的是,ORF10是疱疹病毒中第一个被发现可以抑制宿主mRNA出核转运的毒力蛋白,也是目前报道的第一个能选择性抑制特定mRNA转运的病毒蛋白。然而,ORF10与Rae1-Nup98复合物互作的结构基础,以及ORF10发挥抑制功能的分子机制,目前仍不清楚。
研究人员利用昆虫细胞表达系统,制备了状态良好的ORF10-Rae1-Nup98三元复合物样品,并成功解析了该复合物2.5?分辨率的晶体结构。结构分析发现,ORF10与Rae1-Nup98复合物存在两个主要的互作界面。在这两个互作界面中,ORF10两个高度保守的氨基酸L60和M413贡献了重要的疏水相互作用。通过Co-IP、体外Pull-down、GFP报告基因的表达测定、GFP-mRNA的核质分布测定、RNA FISH成像等多种生化细胞实验, 研究人员明确了L60和M413对维持ORF10与Rae1-Nup98的相互作用、以及对维持ORF10的mRNA出核转运抑制功能都至关重要。 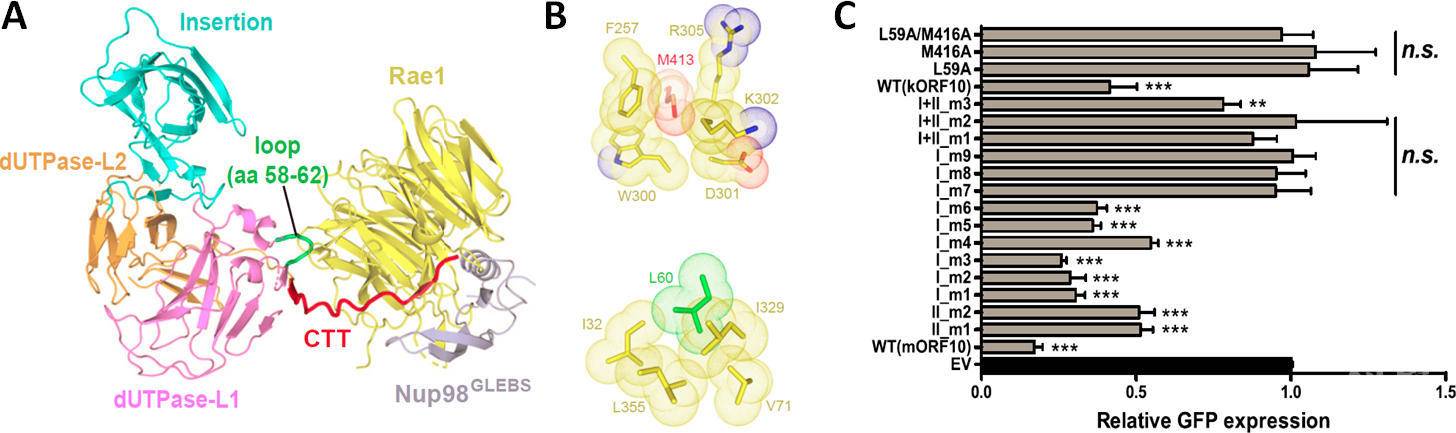
ORF10-Rae1-Nup98复合物结构、互作细节、及突变体对GFP报告基因表达的影响
有意思的是,虽然ORF10占据了Rae1-Nup98复合物自身的RNA结合口袋,但是ORF10-Rae1-Nup98三元复合物却依然保持着足够强的RNA结合能力。研究人员推测ORF10本身可能也具备与RNA的直接结合能力。的确,后续生化实验证实了ORF10可以直接结合RNA。通过对ORF10表面的正电荷聚集区进行系统突变,确定了其结合RNA的位点,并发现ORF10与RNA的互作对其发挥抑制mRNA出核转运的功能非常关键。 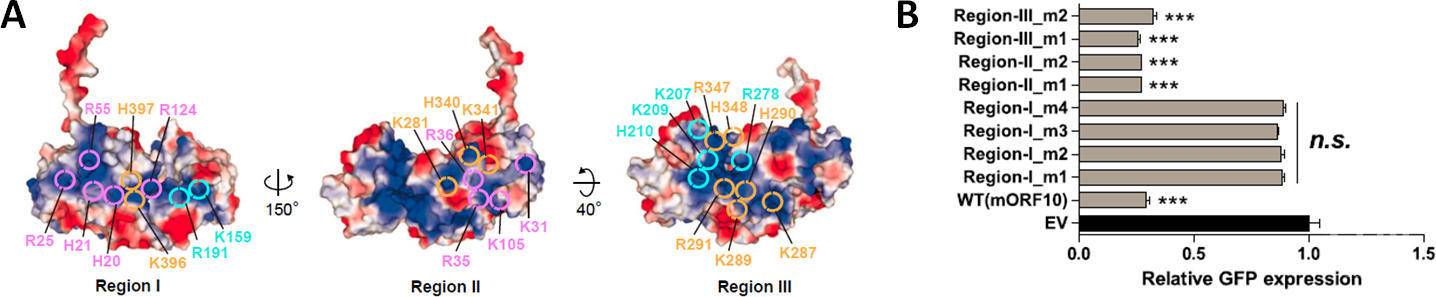
ORF10表面电荷分布,以及突变体对GFP报告基因表达的影响
综上,作者解析了γ疱疹病毒ORF10蛋白与宿主mRNA出核转运复合物Rae1-Nup98的三元复合物结构,明确了两个重要的病毒-宿主互作界面及关键氨基酸,发现了ORF10直接结合RNA的能力及其对抑制宿主功能的重要性。另外,此项工作还意外发现,完全不同的病毒蛋白(如γ疱疹病毒的ORF10蛋白和水疱性口炎病毒的M蛋白)都可以结合到Rae1-Nup98的RNA结合口袋,这提示了该位点的重要性,也为设计新的抗病毒疗法提供了思路。
国家蛋白质科学研究(上海)设施BL17B1线站、BL18U1线站及BL19U1线站工作人员为X射线晶体学衍射数据收集提供了及时有效的支持。
(蛋白质上海设施提供)
内容来源:中国科学院重大科技基础设施共享服务平台
来源:中国科学院重大科技基础设施共享服务平台
原文链接:http://lssf.cas.cn/lssf/dbzkxyjshss/xwdt/202010/t20201022_4558617.html
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



