来源:BioArt
正常细胞在长期进化中形成了一种自我摧毁机制,即经过约50-60次的分裂后细胞会逐渐死亡,而肿瘤细胞由于端粒酶异常活化等原因能够无限分裂而具有永生性。肿瘤细胞的永生性依赖于其与正常细胞不同的生理特征,其中代谢途径的重编程(reprogramming)能够满足肿瘤细胞对能量和细胞大分子的旺盛需求,也是肿瘤发生的特征之一。上世纪20年代,Otto Warburg发现肿瘤细胞即使在氧气充足条件下仍大量利用葡萄糖通过糖酵解而非正常的氧化磷酸化(OxPhos)产生乳酸,这一现象被称为“瓦伯格效应”【1】。虽然瓦伯格效应在各类肿瘤发生中均已得到验证,但近年来发现OxPhos和线粒体依赖性能量合成等过程对一些肿瘤细胞的干性维持(retaining stemness)作用关键【2, 3】,但这些代谢途径是如何促进肿瘤细胞永生的,目前仍不清楚。
与哺乳动物肿瘤发生过程中复杂的肿瘤微环境及高度异质性相比,利用果蝇神经干细胞构建的肿瘤模型相对简约、谱系清晰且易于利用多种生物学标记进行示踪,是研究肿瘤发生中代谢重编程的良好模型。成神经细胞(NBs, neuroblasts)中RNA结合蛋白Brain tumor(Brat)的突变会诱导神经前体细胞的细胞周期异常,产生具有永生性的肿瘤成神经细胞(tNBs, tumor NBs),最终形成具有高致死性的脑瘤【4】。虽然所有的脑NBs都处于静止状态并在化蛹过程中分化或死亡,但tNBs可以持续增殖到成虫期,表明其主要的扩散控制机制发生异常。尽管如此,我们对控制tNBs永生及tNBs抵御变态发育诱导细胞分化的机制仍知之甚少。
近日,奥地利科学院分子生物技术研究所Juergen A. Knoblich博士课题组在Cell 杂志发表了题为“Oxidative Metabolism Drives Immortalization of Neural Stem Cells during Tumorigenesis”的长文,发现果蝇“脑瘤”发生过程中线粒体融合能够诱导肿瘤细胞的氧化磷酸化和NAD+代谢,而NAD+的过度合成是诱导肿瘤细胞永生的关键因素。

为验证果蝇神经干细胞的永生是否伴随着代谢变化,作者首先比较了正常的II型NB细胞(NBIIs)与Brat敲低诱导的tNBs中与糖异生、糖酵解和OxPhos等能量代谢有关的酶类表达水平是否发生变化,发现tNBs中一些与糖酵解和促发酵有关的酶类表达上调,而与OxPhos有关的酶表达不变或下调,表明bratRNAi导致的脑瘤发生时果蝇会以牺牲OxPhos为代价增强糖酵解活性。通过直接监测脑瘤组织的代谢变化,作者发现脑瘤细胞的氧消耗率(OCR, oxygen consumption rate)和细胞外酸化率(ECAR, extracellular acidification rate)升高,且OCR/ECAR也明显上升,表明氧化代谢上调。靶向代谢组分析表明脑瘤组织中一些三羧酸循环(TCA)循环中间产物、乳酸和丙酮酸上升。进一步研究发现,以Gln(谷氨酰胺)为碳源的TCA中间产物循环效率更高。因此,脑瘤组织主要依靠Gln而非葡萄糖为碳源支持OxPhos,且由Gln产生TCA循环中间产物在TCA循环中在OxPhos中发挥了更加积极的作用,表明脑瘤细胞优先利用Gln供应OxPhos。通过构建表达NADH和NAD+“传感器”(SoNar)的转基因果蝇,作者检测了脑瘤细胞的能量来源,发现大多数脑瘤细胞利用OxPhos而非糖酵解获得能量。
通过流式细胞分选分析脑瘤组织内细胞的异质性后,作者发现其中细胞的异质性较高,绝大多数细胞的增殖能力较弱,但活性氧(ROS)解毒和内质网(ER) /线粒体应激活跃,而少数细胞具有很高的增殖能力和OxPhos活性。分选得到的3类细胞(c1、c2和c3)中,c1中增殖性和氧化性较高的tNBs在肿瘤发生过程中首先产生,而c2和c3中的糖酵解活跃细胞通过生理变化而适应缺氧的肿瘤环境,产生较晚。分析c1特异性转录因子的表达模式后,作者发现pdp1是脑瘤组织中高氧化性和高增殖性细胞亚群的特异性转录调节因子
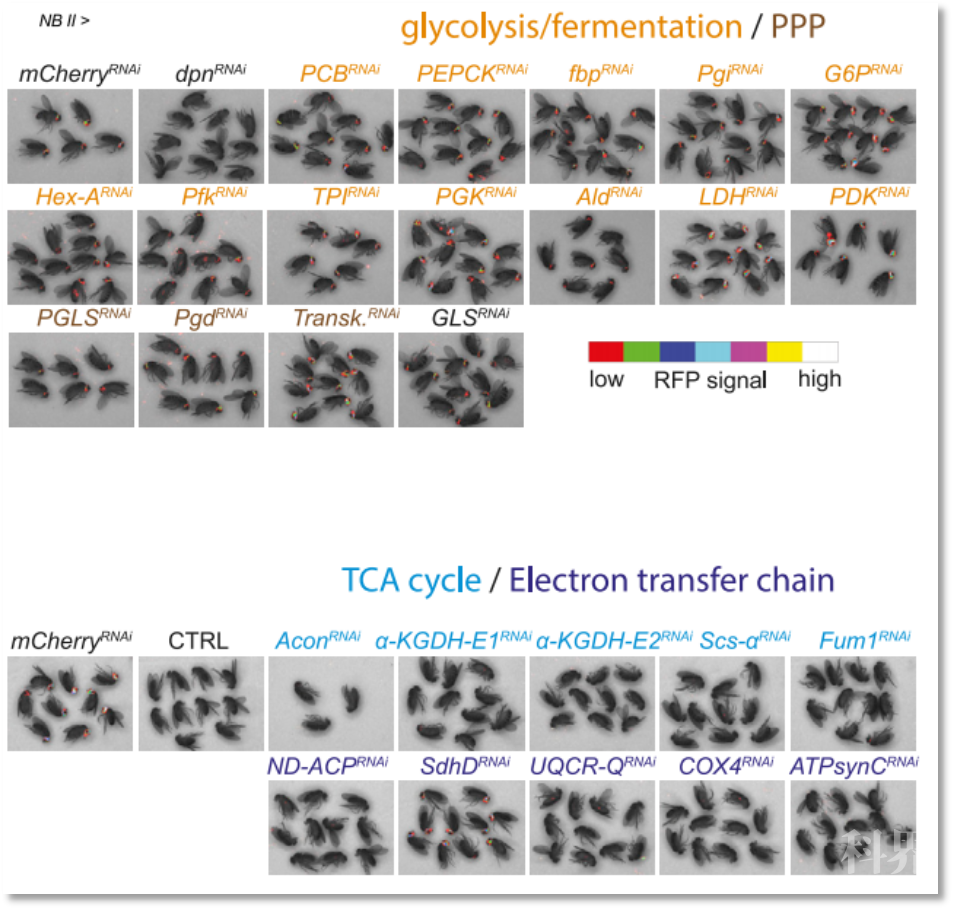
图1 能量代谢基因对果蝇肿瘤发生的影响
为验证代谢变化与肿瘤生长的生物学相关性,作者对影响脑瘤致死率的能量代谢基因进行了筛选,发现与糖异生、糖酵解或发酵相关酶的敲低并不能延长患脑瘤果蝇的寿命,而敲低TCA相关酶类或电子传递链(ETC)组分的编码基因会诱导肿瘤的恢复。肿瘤特异性RFP成像数据同样表明敲低糖酵解、发酵及磷酸戊糖途径相关酶的编码基因并不会降低肿瘤负荷,而敲低TCA循环相关酶类或ETC组分的编码基因会抑制肿瘤生长(图1)。进一步研究证明,OxPhos对于肿瘤细胞增殖是必需的,而正常的NBII细胞的增殖并没有特别依赖于OxPhos,缺氧环境不会影响正常NBII细胞的增殖,但会抑制脑瘤细胞的生长。上述研究证明了当NBs变成致瘤性tNBs时,细胞代谢会从糖酵解转变为OxPhos。
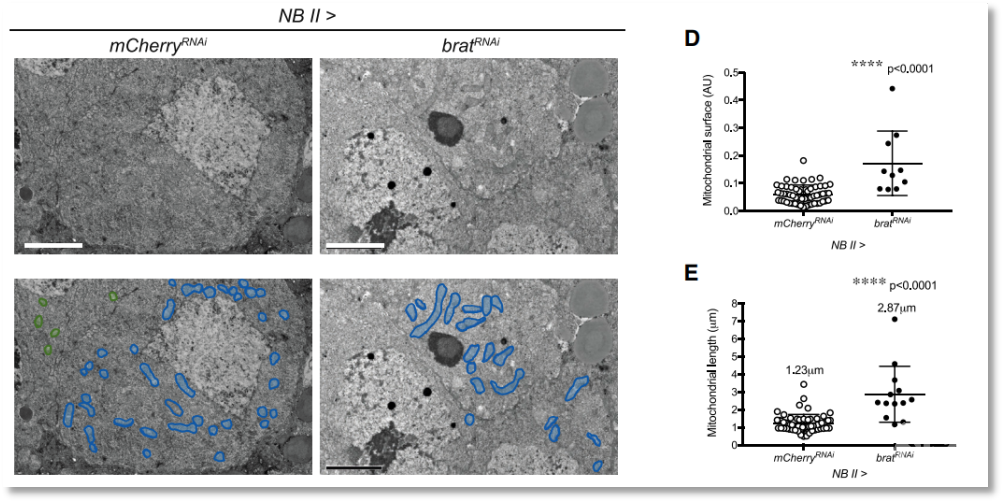
图2 tNBs细胞中线粒体融合异常增强
由于tNBs中TCA循环的关键酶及ETC组分编码基因的转录水平变化不明显甚至下调,因此作者再次分析了转录组数据,以寻找导致上述代谢重编程的其他原因。分析后发现与线粒体融合有关的Marf和Opa1基因表达上调,线粒体融合已被证明是OxPhos的诱导因素【5】,而tNBs的线粒体形态出现增大和伸长等融合表型(图2),且这些融合线粒体的ETC活性上升。tNBs中敲低Marf或Opa1的表达会抑制线粒体融合,同时也会抑制肿瘤的生长。因此,线粒体融合是果蝇bratRNAi型脑瘤发生的重要原因,也是诱导果蝇tNBs代谢重编程的关键因素。随后作者使用SoNar检测了NBII谱系的细胞在肿瘤发生过程中的代谢状态,发现brat敲低一段时间(48h)后肿瘤起始细胞中NADH和NAD+水平显著上升,且线粒体融合、NADH/NAD+“生物能开关”(bioenergetic switch)的开启与肿瘤起始细胞的永生化过程相同步。OxPhos和线粒体融合对bratRNAi 诱导肿瘤细胞的永生化不可或缺,而相比于氧化代谢中ATP或ROS的生成,NAD+代谢是TICs永生化的关键原因。
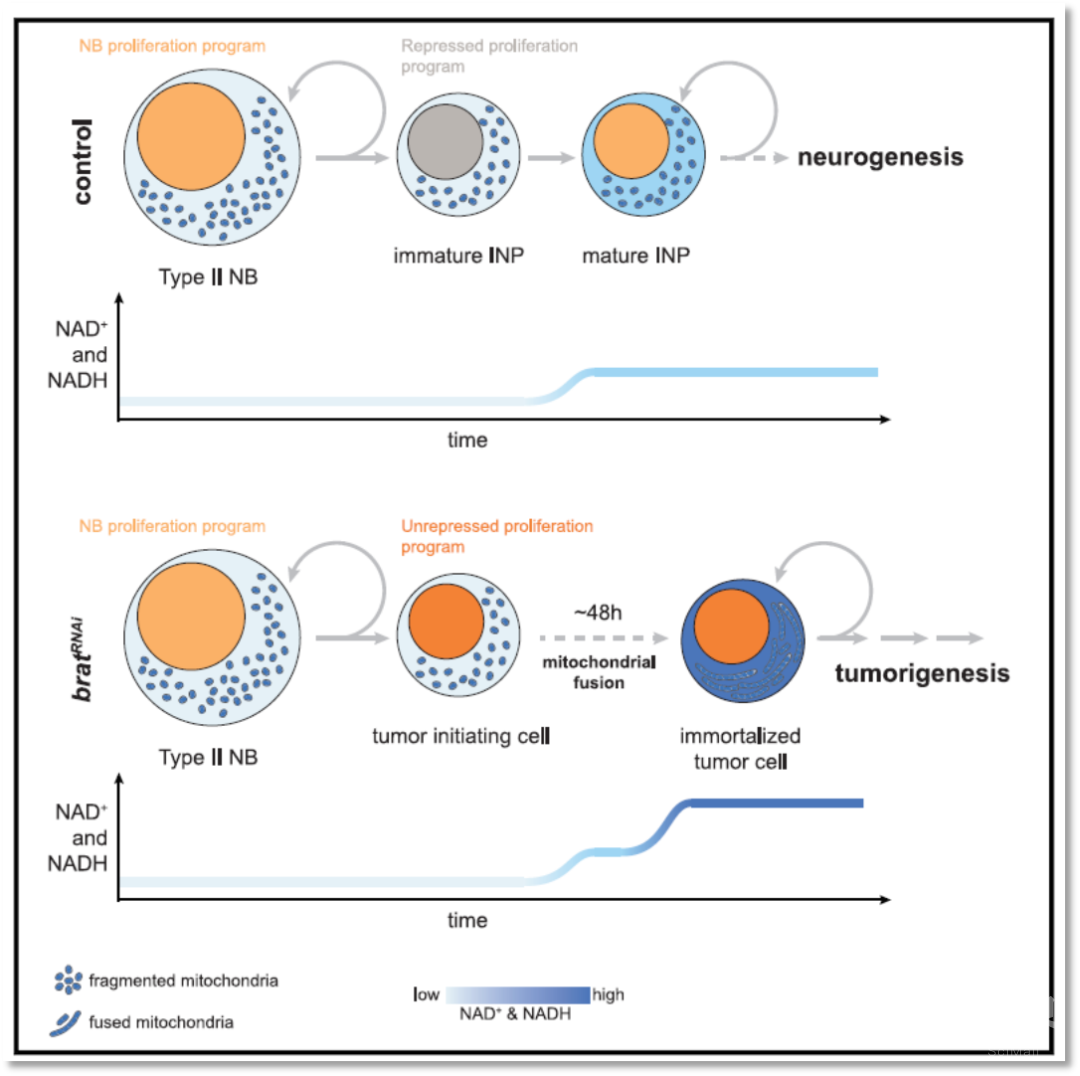 图3 线粒体融合诱导的代谢重编程导致了肿瘤细胞的永生
图3 线粒体融合诱导的代谢重编程导致了肿瘤细胞的永生
综上所述,本研究利用单细胞转录组学及细胞谱系示踪等技术发现转录因子brat敲低所诱导的果蝇脑瘤组织中存在一个分裂和氧化磷酸化活跃的干细胞亚群,结合靶向代谢组学和体内基因筛选,证明线粒体融合通过诱导氧化磷酸化和NAD+代谢促进了肿瘤发生过程中神经干细胞的永生(图3)。
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652503867&idx=1&sn=a67f48800e6eb5b1b08874e2518b25e3&chksm=84e26c8fb395e599730f62de1dbbcd22b0d2c172bfa54813a7c258735cd4fab6f8fea157854c#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn


