来源:BioArt
葡萄糖代谢是多细胞生物新陈代谢活动的重要组成部分,糖代谢调节的失衡会导致一系列疾病的发生,如生长发育紊乱和糖尿病。在哺乳动物中,血糖浓度的稳态主要依靠胰岛β细胞和α细胞分泌的胰岛素和胰高血糖素进行调控。胰岛细胞的功能可以受到神经-体液双重调节,其中血糖对胰岛细胞功能的直接调节已经被广泛认识,而神经系统对胰岛细胞功能的调节机制则更加复杂。值得一提的是,人们已经在哺乳动物中枢神经系统中发现了具有葡萄糖感测功能的神经元。这类神经元可以影响动物血糖的调控和葡萄糖稳态,然而其背后的调节机制则不完全清楚【1】。
果蝇作为经典模式生物,其糖代谢过程与哺乳动物的高度相似性使其成为糖代谢和糖尿病研究的有效工具。果蝇基因组可以编码多个胰岛素样多肽(Drosophilainsulin like peptide,Dilp)以及与胰高血糖素同源的激脂激素(Ddipokinetichormone,Akh),从而完成对糖代谢的双向调节【2】。果蝇体内同样存在可接收葡萄糖信号刺激的中枢神经元【3,4】,然而与哺乳动物中的情况相似,这类神经元对果蝇糖代谢活动的影响则尚属未知。
2019年10月24日,纽约大学医学院GregSuh实验室在Nature杂志上发表了题为Aglucose-sensing neuron pair regulates insulin and glucagon in Drosophila的文章,成功识别了果蝇中枢神经系统中一对特定的葡萄糖感测神经元,并阐释了这组神经元对果蝇胰岛素和胰高血糖素同源激素的直接调控机制。

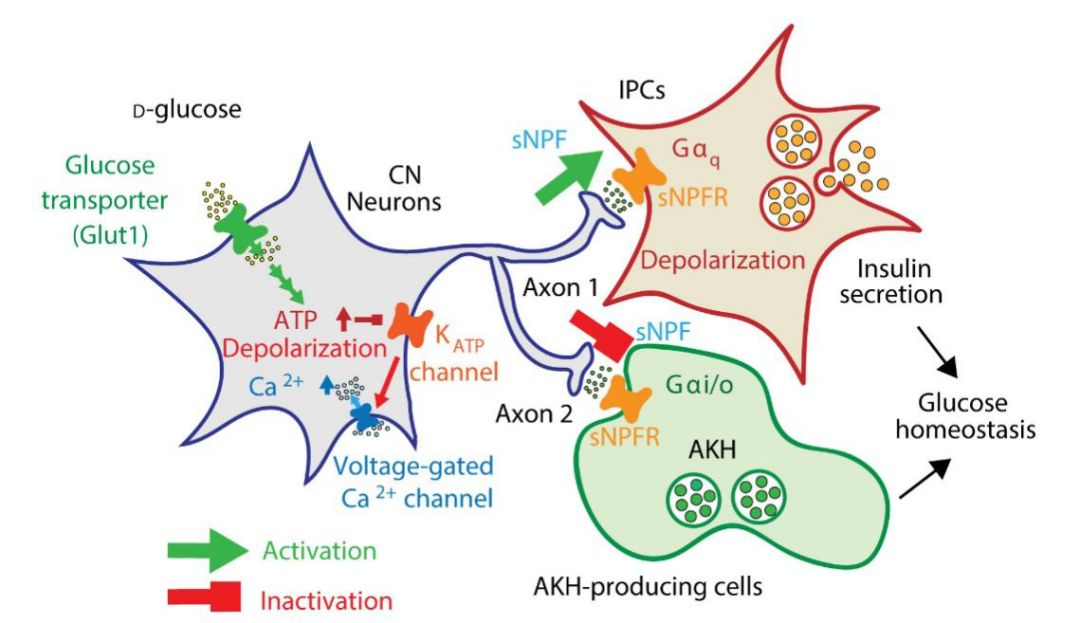
在文章中,作者首先利用大量果蝇Gal4驱动子品系(Gal4driver line)对果蝇神经元进行随机抑制,并在此基础上筛选对D-葡萄糖和L-葡萄糖分辨能力缺失的个体。通过筛选,作者发现两个不同的导致葡萄糖感知缺陷的驱动子品系共同标记了一对位于中枢神经系统背外侧的神经元。由于这对神经元可以被Crz-Gal4驱动子标记并表达短神经肽F(Shortneuropeptide F,sNPF),作者将此神经元命名为CN神经元。通过对CN神经元进行抑制,作者确认了其在葡萄糖感知功能中的重要作用。而进一步利用GFP对CN神经元进行标记,作者发现CN神经元的轴突通过二分叉分别向中枢神经系统脑间部(ParsIntercerebralis,PI)和位于中枢神经系统腹侧的心侧腺(CorporaCardiaca,CC)进行投射。由于果蝇合成Dilp的神经内分泌细胞(Insulin-producingCell,IPC)位于PI区域内,而CC则是合成Akh的主要器官,故作者假设CN神经元可以通过其轴突信号直接影响Dilp和Akh的分泌功能。
由于CN神经元在葡萄糖感知过程中的重要作用,作者首先确认了糖类对CN神经元的直接刺激。利用离体脑组织培养和与钙信号监测技术,作者发现CN神经元可接收多种可生物利用的糖类的刺激,如D-葡萄糖、D-果糖和D-海藻糖,但对L-葡萄糖、蔗糖和氨基酸则没有反应。在此基础上,作者验证了糖类刺激CN神经元的作用机制。与胰岛β细胞相似,CN神经元对糖类的刺激反应依赖于糖类的吸收、转运、代谢过程以及后续钙信号的激活,而这一结果进一步确认了CN神经元作为糖类感测神经元的功能。
接下来作者检测了CN神经元活动对IPC和CC细胞功能的影响。利用GFPReconstitution Across Synaptic Partners(GRASP)方法,作者首先验证了CN神经元与IPC以及CC细胞间的直接触相互作用。在此基础上,通过对细胞内钙信号以及Dilp和Akh水平的监测,作者发现CN神经元对IPC和CC的分泌功能起到相反的作用。激活CN神经元可以促进IPC中Dilp的分泌,抑制CC细胞Akh的分泌,而抑制CN神经元则相反。这一结果明确的支持了作者的假设,证明了CN神经元可以通过调节Dilp和Akh的分泌对果蝇糖代谢产生调控功能。
于此同时,作者也研究了CN神经元对IPC和CC细胞产生反向作用的分子机制。作者发现,sNPF作为神经递质介导了CN神经元与IPC以及CC细胞间的信号传递。在IPC中,sNPF受体与Gq蛋白结合,介导了CN神经元对IPC的激活。而在CC细胞中,sNPF受体则与Gi/o蛋白结合,完成了相反的功能。
综上,本文利用果蝇大规模遗传学筛选的优势,成功的识别了一组对果蝇糖代谢产生直接调节作用的神经元。文章证实了果蝇的胰岛素-胰高血糖素系统同样受到体液和神经的双重调节,并且指明了其中一条清晰的神经内分泌调节通路。这一发现对于果蝇糖代谢和糖稳态的研究具有重要意义,对哺乳动物的相关研究也将具有一定的借鉴价值。
原文链接:
https://doi.org/10.1038/s41586-019-1675-4
参考文献
1. Thorens, B. (2014). Neural regulationof pancreatic islet cell mass and function. Diabetes Obes Metab 16 Suppl 1, 87-95.
2. Graham, P., and Pick, L. (2017).Drosophila as a Model for Diabetes and Diseases of Insulin Resistance. Curr TopDev Biol 121, 397-419.
3. Dus, M., Lai, J.S., Gunapala, K.M.,Min, S., Tayler, T.D., Hergarden, A.C., Geraud, E., Joseph, C.M., and Suh, G.S.(2015). Nutrient Sensor in the Brain Directs the Action of the Brain-Gut Axisin Drosophila. Neuron 87, 139-151.
4. Lopez-Gambero, A.J., Martinez, F.,Salazar, K., Cifuentes, M., and Nualart, F. (2019). Brain Glucose-SensingMechanism and Energy Homeostasis. Mol Neurobiol 56, 769-796.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652477017&idx=4&sn=a059d1fedae67f2f8e271d26ab071b7b&chksm=84e205edb3958cfb5fc0e54aa24ab995a72f4dbfe7d3d83f8e68a65130215094250cd6f4457d&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



