来源:X一MOL资讯
注:文末有本文科研思路分析
近日,湖南大学张晓兵团队发展了一种新型双因子激活诊疗纳米探针用于体内分子成像和高特异性癌症治疗。该工作是在张晓兵教授带领下,其团队成员宋国胜教授协助指导博士生滕丽丽(第一作者)等人完成的,这一研究成果近期发表在J. Am. Chem. Soc.上。
目前,大多数癌症治疗,包括化学疗法、放射疗法或光疗法等,会对正常组织产生非特异性化学毒性、放射性毒性或光毒性,这些非特异毒性往往会引起严重感染、恶心和肾脏等问题。基于肿瘤微环境(TME)的特征,科学家们目前开发出多种可激活的纳米材料,这些纳米材料在癌症生物标志物的刺激下能够对癌细胞进行特异性破坏,从而降低红外激光或X射线照射等对正常组织的毒副作用。然而,大多数可激活的纳米材料仅对单一刺激响应。这种单因子激活的信号通常不足以明显的区分癌症病变部位与正常组织,导致潜在的假阳性或假阴性诊断结果。为了进一步提高癌症成像和治疗的精准性,迫切需要多种癌症相关生物标志物共同激活的智能纳米探针。
光声(PA)成像作为一种非侵入性成像技术,是组织或造影剂通过脉冲激光照射产生的热膨胀引起的声学信号。与传统的荧光或生物发光成像技术相比,PA成像能够显着改善体内成像深度和空间分辨率。目前,大多数PA探针都因单因子激活或单信号输出而受成像深度,探针含量或异质分布的影响。为了提高成像精度等问题,迫切需要开发出多因子激活的、多信号输出的PA成像探针。
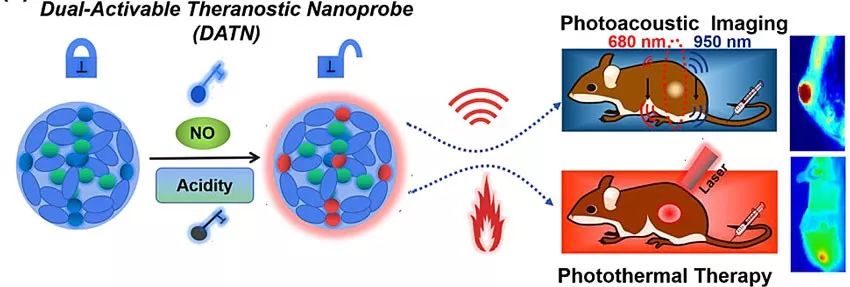
近日,该团队设计了一种“双钥匙-单锁”智能纳米探针,用于高特异性的癌症成像和光热治疗。基于肿瘤微环境中较高水平的NO和低pH值的特性,团队设计合成了NO/酸共激活的(D-π-A-π-D)型响应分子,同时合成了另一种惰性分子作为内参,通过组装形成纳米粒子。只有在NO和酸的共激活下,纳米探针的光声、光热性能开启,通过输出比例光声、光热信号,用于高特性的肿瘤成像和肿瘤光热治疗。由于肿瘤中常常并发炎症,该双因素激活策略,有望提高肿瘤成像和治疗的特性异性和精准度,从而降低癌症治疗的严重毒副作用。未来该策略还可以拓展到对肿瘤更加特异性的生物标记物(如基质金属蛋白酶),来进一步提供肿瘤成像和治疗的精准度。
来源:X-molNews X一MOL资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwOTExNzg4Nw==&mid=2657621960&idx=7&sn=9b6c4f6fa9f2697937a14f21f04b822b&chksm=80f83e18b78fb70e79eb352c6f8162e1a955705a46072ec5c27f0eba6ff1d358a1abfc7dcc47&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



