来源:植物科学最前沿
摘要:植物作为固着生物必须要适应环境中的各种生物和非生物胁迫。植物能够通过各种信号分子来整合并传导来自根部和叶片等器官感受到的环境信息,其中,小蛋白、多肽、mRNA、激素和代谢物质等作为信号传导分子在植物响应环境胁迫的过程中起到了十分重要的作用。虽然植物不具备和动物一样的神经系统,但是它们可以通过其独特以及复杂的信号分子精准地联系和调控各组织和器官来响应胁迫从而适应周围的环境。本文综述了近年来报道的植物中参与响应胁迫的重要信号分子的作用机理,并重点阐述了植物通过长距离信号传导响应胁迫的研究进展。
关键词:植物;胁迫;激素;多肽;信号传导

植物作为固着生物无法逃避不利于生长和发育的胁迫环境,因此需要不断地应对多变的环境。植物为了更好地适应周围的环境,发展起了一套独特的调控系统响应环境胁迫(Nakashima et al,2014)。干旱、高温、冷害和强光等胁迫都会对植物的正常生长发育造成影响,因此,探索和阐释植物响应胁迫的机理对提高植物的抗性是十分必要的。近年来,极端天气频发,加剧了非生物胁迫对农业生产的影响,因此,提高植物的抗逆性对农业生产和环境的可持续性发展都是至关重要的。
在植物抗逆性的研究中发现,植物具有多种系统性的信号分子如激素和钙离子等,这些信号分子在植物响应胁迫中起着重要的作用。与动物不同,植物没有中枢神经系统,它们需要通过维管组织在根和芽中整合并交流地上、地下部分的环境信息。一些可移动的信号分子可以通过维管组织传导环境信息帮助植物响应环境胁迫。本文综述了参与植物响应胁迫的信号分子(包括ABA、ROS和多肽等物质)在响应胁迫的过程中涉及到的信号传导机制。其中,重点阐述了多肽在植物响应胁迫中的作用机理以及植物长距离信号传导的研究进展。
1 ABA参与响应干旱胁迫中的信号传导
脱落酸(ABA)主要是由植物的根部产生,其作用是促进植物气孔的关闭以及促进植物根系对水分的吸收。植物的根系中含有ABA合成的酶和前体物质,这些物质能够感受到土壤中根系周围的水分状态并做出相应的反应,最终通过控制ABA的合成响应干旱胁迫。
植物的根部能感受土壤中的干旱胁迫,然后将缺水信号传递到茎、叶和保卫细胞等远距离的组织和细胞中(Christmann et al,2013)。植物通过减小各个组织部位细胞的膨胀程度来响应干旱胁迫是其在缺水环境中赖以生存的重要途径。细胞膨胀程度的改变产生的渗透胁迫信号可以快速的从根部传导到叶片,从而诱导脱落酸(ABA)的积累,最终引起植物气孔关闭降低蒸腾作用。有研究表明葡萄的气孔关闭主要是由于植株中细胞渗透压降低诱导ABA积累造成的(Tombesiet al,2015)。
植物在感受到环境胁迫后能快速的将体内的钙离子(Ca2+)信号从传感组织传导到靶标组织中(Kudla et al,2018)。细胞外的Ca2+主要是通过质膜蛋白和钙离子通道运输到细胞内的。有研究报道拟南芥中的OSCA1就是一种质膜蛋白,它可以介导Ca2+的迅速积累并促使保卫细胞的气孔关闭(Yuan et al,2014)。这表明,当植物遭受胁迫时钙离子在细胞内的迅速积累可以在短期内导致气孔的关闭,而这一过程要比ABA合成并转运到保卫细胞中更快,因此可以对干旱胁迫做出较为迅速的反应(如图1)。
干旱胁迫会引起植物体内ABA水平的升高,ABA的积累会引发气孔关闭,降低蒸腾作用从而减少水分的丢失。2001年,日本学者Kazuo等发现拟南芥中的AtNCED3基因是参与内源ABA合成的关键基因,超表达该基因能够提高内源ABA的水平,促进受干旱胁迫或者ABA诱导的相关基因的表达(Iuchi et al,2001)。后期的实验结果表明,AtNCED3主要在叶片的维管组织中表达(Endo et al,2008)。有研究人员通过用ABA合成受阻的突变体与野生型番茄嫁接的实验证明,ABA在叶片中的合成对干旱胁迫下气孔的关闭有调节作用,而ABA在根中的合成并没有此作用(Holbrook et al,2002)。ABA在叶片中合成积累主要是受干旱胁迫信号的调节,而干旱胁迫信号是由根细胞的渗透压降低引发的(Christmann et al,2007)。然而长久以来,关于干旱胁迫信号是如何以及以何种形式从根系长距离传导到叶片中一直是未解之谜。
最近,有研究发现拟南芥中的小肽CLE25,可以通过维管组织将干旱胁迫信号从根尖长距离传导到芽尖,从而调控叶片中ABA的生物合成和气孔关闭(Takahashi et al,2018)。植物中,根到芽的信号传递对于防止蒸腾作用损失水分和适应干旱环境是非常重要的。在根的维管组织中产生的CLE25可以从根部运输到叶片中并诱导NCED3的表达,NCED3的表达能增加ABA在叶片中的积累以响应干旱胁迫。目前,根的维管组织分泌CLE25的机理并不清楚。BAM1和BAM3是CLE25在叶片中的受体,在接收到CLE25传递的信号后BAM1和BAM3可以通过促进ABA的积累调控气孔的开度从而响应干旱胁迫。以上结果表明,植物的根可以感受缺水状态,并能分泌一种小肽CLE25,CLE25可以通过维管组织将干旱胁迫的信号从根部长距离的传导到叶片(合适的靶标器官),从而通过一系列的应激反应达到优化植株生长状态的目的。CLE25–BAM长距离信号传导系统的作用可能是在植物响应干旱胁迫时维持叶片中稳定的ABA含量。植物在响应干旱胁迫的不同时期通过一些不同的信号分子调控气孔的关闭,这是由于持续的干旱胁迫导致根和叶之间会产生一些物质的变化(如图1)。
ABA能诱导植物组织和器官中各种不同类型基因的表达,以增强植物抵抗干旱胁迫的能力(Hirayama et al,2007)。前人的研究表明,组织特异性的ABA生物合成酶主要定位于叶片的维管束中。此外,ABA的分布可能由一些转运蛋白严格调控,如拟南芥ATP结合转运蛋白AtABCG25和AtABCG40,硝酸盐转运蛋白/肽转运蛋白(NPY)AtNPF4.6/NTR1.2,以及毒素排出转运蛋白AtDTX50(Kuromori et al,2007)。ABA主要是以水为载体,从合成部位扩散到特异性的组织器官中,它可以从植株叶片的维管组织中将缺水信号传导到其它组织中。ABA可以在细胞和细胞间传递,或者作为中等距离的信号分子从叶片维管组织传导到气孔以及其他叶片组织中响应胁迫。在长期的干旱胁迫条件下,ABA能介导很多胁迫相关基因的表达来抵抗干旱胁迫(如图1)。
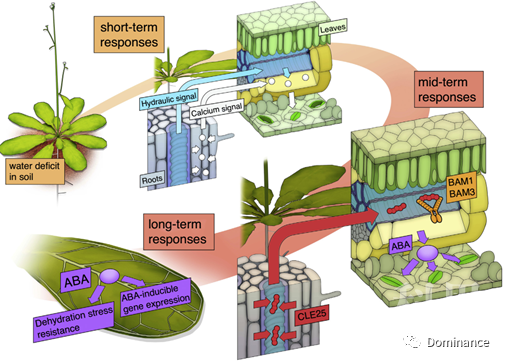
图1 植物响应干旱胁迫途径(Fuminori et al,2018)
2 ROS信号传导对植物响应胁迫的调控
2.1 ROS的产生部位及其作用
活性氧 ( reactive oxygen species,ROS)是植物正常生长发育过程中重要的信号分子,主要包括超氧自由基(O2 -)、氢氧根离子( OH-)、羟基自由基(–OH)、过氧化氢( H2O2 )等类型。ROS在植物响应生物和非生物胁迫以及对环境的适应中都起着非常重要的作用。在正常情况下,植物体内的ROS能够在Ca2+的诱导下产生(Choiet al,2014)。植物中产生ROS的部位主要有线粒体、内质网、叶绿体、质外体和质膜等。有研究证明,胞质内的Ca2+浓度升高后细胞会在ACAs(auto-inhibitedCa2+ ATPase)、CAX ( Ca2+/H+ exchanger antiporter)等转运蛋白作用下将胞质内的Ca2+转运到胞质外,以维持细胞中Ca2+的稳态(Farmeret al,2014)。植物的叶绿体中产生的H2O2以及线粒体中经过呼吸链和酶促反应产生的H2O2最终都会转运到胞质和核中,细胞中的H2O2能够诱使Ca2+浓度的升高,在过高的Ca2+浓度下会诱导产生大量的ROS(Huanget al,2016)。此外,在植物免疫反应和响应胁迫等情况下,也会诱导过氧化物酶体产生大量的ROS(Apelet al,2014)。
植物可以通过ROS响应胁迫适应环境,同时ROS又是植物有氧代谢的有毒副产物,因此ROS在植物的生长发育中起着双重作用(Dietz et al,2016)。ROS参与许多植物的氧化还原过程,是一个复杂的但同时高度协调和灵活的氧化还原信号网络(Mittleret al,2004)。ROS能形成一个局部氧化环境,促进其他途径的信号传导,如钙离子波、巯基二硫键交换、蛋白质相互作用和转录因子结合。细胞外ROS,如扩散的H2O2既能迅速将胞内信号传输到细胞核,也能放大从叶绿体和线粒体到细胞核的信号(Juvanyet al,2013)。
2.2 ROS信号的胞间传导
ROS与植物响应生物或者非生物胁迫有着密切的联系。植物的ROS/Ca2+波是植物快速传递信号体系的重要组成部分(Suzuki et al,2013)。除RBOH外,ROS也是系统信号传递的介质,例如ROS在黄嘌呤脱氢酶的作用途径中就扮演着系统信号传递的角色(Maet al,2016)。另外,ROS在一氧化氮(nitricoxide,NO)和脱落酸(abscisic acid,ABA) 介导的生物和非生物胁迫应答反应中也起到了重要的作用(Mittleret al,2015)。最近的研究表明,在水稻中利用CRISPR /Cas9 技术敲除 RBOHH 可以减少水稻根系ROS的积累,从而通过调控乙烯的产生促进水稻根系通气组织的形成(Yamauchi et al,2017)。乙烯在植物免疫上的作用也与ROS有着千丝万缕的联系,通过对水稻稻瘟病机理的研究发现:乙烯在抗病信号中可能是通过对ROS产生的调控从而起到调节作用的(Yanget al,2015)。在拟南芥中的研究发现声波可以引发细胞内Ca2+快速积累,从而进一步引发ROS的产生(Noctoret al,2017)。近年来,ROS的信号传导机制以及它能增强植物抵抗生物和非生物胁迫的能力越来越被人们所重视。
2.3 ROS对植物获得性抗性的调控
ROS在植物的细胞器和细胞间的通讯中起到了很大的作用,细胞间的通讯信号需要ROS代谢系统传导(Rodrigomorenoet al,2017)。关于植物系统获得性抗性(SAR)途径中响应ROS不同信号通路之间联系的研究在近些年取得了较大的进展,特别是韧皮部传导信号的发现,以及鉴定了几种生物活性分子,包括水杨酸甲酯、3-磷酸甘油(G3P)衍生物和茉莉酸等(Dempsey et al,2017;Shah et al,2013)。研究还发现,对局部组织施用水杨酸甲酯、G3P、AZA或脱氢松香醛时,会激活SAR途径(Kachroo et al,2013),并且在整个信号路径中快速积累JA(Glauser et al,2009)。在拟南芥突变体 rbohd中可以观察到G3P的浓度比较低,但外施G3P可诱导SAR途径发生(Wang et al,2014)。最近的研究表明,以上分子的合成很可能是受ROS调控的。这些结果说明ROS参与了植物的SAR调控途径。
2.4 ROS/Ca2+波作为长距离信号响应强光胁迫
植物的气孔开度受很多种非生物胁迫的响应机制调节,其中就包括强光胁迫。当植物遭受强光胁迫时,气孔会快速关闭以降低光合作用和蒸腾作用。强光胁迫能介导植物大量积累ABA,从而诱导NADPH氧化酶D(RBOHD)产生ROS,进而引起ROS/Ca2+的波动,这种波动能调节植物受胁迫部位叶片气孔开度(Devireddyet al,2018;Yoshidaet al,2018)。受强光胁迫产生的ROS/Ca2+波可以从叶片的局部区域快速的传递到整个叶片,从而增强整个植株对强光胁迫的反应。ROS/Ca2+波是ABA和茉莉酸(JA)的上游调控物质,ABA和JA可以在GHR1和S型阴离子通道SLAC1的介导下系统性的调控叶片气孔的开度。这些结果表明,植物在强光胁迫的条件下,ROS/Ca2+波可以作为长距离的信号激活ABA的产生,进而系统性的调控叶片气孔关闭以响应强光胁迫。
3 GLR在植物响应胁迫中的信号传导
3.1 AtGLR家族的构成和功能
1998年,有学者在拟南芥中首次发现了与哺乳动物iGluRs高度同源的拟南芥谷氨酸受体基因AtGLR(Lam et al,1998), 随后发现该基因家族包含20多个AtGLRs(Lacombe et al,2001)。单一细胞质 mRNA RT-PCR 的结果显示:AtGLRs基因在同一个体的不同组织间协同表达的种类和数量差异较小, 而在不同个体的相同组织中却存在较大差异,这说明AtGLR基因家族成员间可能存在功能冗余现象(Roy et al,2008)。
有科研人员利用突变体 glr3.3 进行电生理实验发现, 谷氨酸不能激发突变体glr3.3的细胞膜去极化,胞质的Ca2+浓度也未出现峰值, 因此推测 AtGLRs参与了植物的钙离子调控(Qi et al,2006)。通过与大鼠GluR1和GluR6的融合实验, 发现AtGLR1.1和AtGLR1.4具有对 Na+、K+和 Ca2+选择性通透的核心结构域(Tapken et al,2008)。超表达AtGLR3.1基因能减弱Ca2+诱导的气孔关闭反应, 说明AtGLR3.1与Ca2+调控的气孔关闭运动相关。因此, 从上面的实验结果可以推测AtGLRs具有通过谷氨酸调控Ca2+进出细胞的功能。
通过对拟南芥AtGLR3.4基因启动子融合 GUS 转基因植株提供机械损伤刺激, 发现机械损伤胁迫能够诱导AtGLR3.4 表达量增加(Meyerhoffet al,2005)。有研究表明,低温胁迫能够诱导拟南芥细胞膜快速去极化和促使细胞外Ca2+流入胞内,导致胞质Ca2+浓度快速的升高(Lewis et al,1997)。通过定量 RT-PCR分析发现低温处理5min,再放回正常环境15min之后,AtGLR3.4基因表达水平达到最高,但此效应能被质膜Ca2+通道抑制剂La3+阻断。用一定浓度ABA对实验材料进行处理,发现ABA并不影响AtGLR3.4基因的表达。据此推测AtGLR3.4基因在环境胁迫快速响应机制中的作用可能与Ca2+信号有关, 而与ABA无关。
3.2 GLR介导长距离信号传导响应机械损伤胁迫
植物在受到机械损伤时会向叶片局部区域和其他叶片传导创伤信号,系统性的响应昆虫或者病原菌对植物的损伤胁迫。有研究表明,GLR可以编码阳离子通道蛋白,在先天性的免疫反应中可以介导钙离子流入细胞内(Kwaaitaal et al,2011)。最近,有研究揭示,GLR家族的两个成员GLR3.3和GLR3.6能够在叶片受到机械损伤的部位诱导谷氨酸积累,从而产生钙离子波和膜电位信号,将胁迫信号传导到较远的叶片中进而增强JA响应基因的活性(Toyota et al,2018)。长距离的钙离子波可以通过维管束快速的传导到其他组织部位,这个速度可以快达1毫米/秒。更进一步的研究表明,在系统性的机械损伤胁迫应答中膜电位的变化是Ca2+波的上游影响因子(Nguyen et al,2018)。一些GLRs包括GLR3.3和GLR3.6(GLR3.3是定位在韧皮部筛管组织的内质网上,而GLR3.6定位在木质部接触细胞的液泡膜上)虽然在植物组织中的分布位置不同,但是在维管组织中的功能是相同的。GLR3.1蛋白在木质部和韧皮部的内质网上都有积累,这表明木质部和韧皮部都可以在GLRs的通讯系统调控下通过Ca2+波介导来响应机械损伤胁迫。
4 多肽信号传导响应胁迫
4.1 多肽是植物体内的信号传导物质
多肽是α–氨基酸以肽键连接在一起而形成的化合物,它也是蛋白质水解的中间产物。由两个氨基酸分子脱水缩合而成的化合物叫做二肽,同理类推还有三肽、四肽、五肽等。通常由10~100个氨基酸分子脱水缩合而成的化合物叫多肽。多肽在植物的生长、发育、生殖和对外界环境响应中具有重要的调控作用。近年来,有研究表明多肽类物质在植物体内也具有传递信号的功能。植物体内存在着以多肽为信使参与的防御反应、顶端分生组织细胞的分裂分化以及花粉与柱头相互识别等生命活动。多肽在植物生长发育中的信号传导能够提高植物的抗逆能力,增加植物对肥料的利用率以及提高植物的生物量。
4.2 多肽信号系统参与响应氮胁迫和根瘤的形成
多肽在植物响应环境胁迫以及不同组织器官间的交流中都起着重要的作用。总结前期的研究结果可以发现,多肽在响应氮胁迫和根瘤的形成过程中起着长距离的信号传导作用。碳端编码肽(CEP)的C端附近编码了一个具有小的保守的结构域的分泌肽(Okamoto et al,2016)。拟南芥中CEP家族包含有15个基因。在缺氮的情况下,植物根部的CEP基因会被诱导表达,将根部缺氮信号传导到芽,在芽中CEP能被其受体蛋白CEPR所识别,CEP-CEPR信号会增强芽中CEP下游多肽CEPD1和CEPD2的积累,从而上调根中的硝酸盐转运蛋白的表达(Ohkubo et al,2017)。从上面的研究结果来看,我们发现CEP-CEPR-CEPD这个信号系统可以长距离的传递根到芽和芽到根之间的缺氮信号,最终帮助植物平衡体内的氮元素(Ruffel et al,2017)。
在固氮植物中,土壤中的根瘤菌可以通过感染植物根部形成根瘤,根瘤可以将氮转化为氨或硝酸盐等代谢产物为植物提供营养。豆科植物和根瘤菌属于互利共生的关系,在根瘤菌侵染植物的过程中植物需要控制根瘤的数目以达到最合适的共生状态。有详细的研究报道了植物控制根瘤数目的作用机理(Fergusonet al,2018)。两个CLE根信号肽(CLE-RS)CLE-RS1和CLE-RS2可以将根部硝酸盐富集状态的信号传递到芽,转录因子NIN可以调控CLE-RS的表达以响应根瘤的侵染。转录因子NRSYM1能增强CLE-RS2的表达,在根部形成的CLE-RS能被芽中的HAR1受体蛋白所识别,CLE-RS和HAR1系统能调控细胞分裂素的积累进而抑制根瘤的形成。这说明植物能够整合并传导根和芽中的一系列信息然后做出不同的反应来调控体内的氮积累最终达到氮水平的稳态(Nishida et al,2018)。
4.3 多肽响应其他非生物胁迫
很多多肽都被报道作为信号分子参与响应非生物胁迫,如CLE45、AtPep1、AtPep2和AtPep3等(Arshadet al,2014)。其中,AtPep3是盐胁迫响应多肽(Nakaminami et al,2018)。拟南芥在生殖生长阶段对高温胁迫很敏感,有研究发现多肽CLE45能在高温下促进花粉管的伸长(Endo et al,2014)。CLE45在雌蕊中表达以响应高温胁迫,然而其受体蛋白SKM1和SKM2却被检测到在花粉和花粉管中表达。CLE45- SKM1/SKM2系统可以在高温胁迫的情况下保持植株育性。由韧皮部产生的CLE45可以通过BAM3类受体激酶介导原生韧皮部的分化,这表明CLE45可以在多肽信号的作用下通过特异性的类受体激酶介导参与其它生理生化路径的调控(Ohet al,2018)。
5 总结和展望
植物经过长期的进化已经具有了复杂的生理系统和种类各异的组织器官,可以感知和整合环境中的各种信息,通过长距离的信号传导适应环境并优化其生长状态。在植物响应环境胁迫时,有大量的信号分子参与到调控中,这些信号分子精准地调控植物的生长和对环境的应激反应,使得植物能够像一台完整而精密的仪器稳定的运行。近年来,随着高通量基因组技术的不断发展,很多未被鉴定的分子被发现参与到植物的长距离信号传导中,包括多肽、蛋白质和RNA等。在环境胁迫的情况下,这些信号分子以不同的速度在不同的组织中传导信号,如ROS/Ca2+波能在器官与器官之间快速的传导,多肽CLE25能在筛管中长距离的传导等。目前,植物响应胁迫的机理已经有了一定程度的研究进展,但是关于植物如何感知胁迫的研究仍然知之甚少。
在植物响应胁迫的研究中,发掘并鉴定植物感受胁迫的感受器将是今后研究的重要方向。高效的基因编辑技术和遗传转化方法将帮助我们克服由于基因冗余造成的胁迫感受器在遗传筛选上的困难。通过联系植物胁迫感受器和信号传导分子的作用机理可以更好地帮助我们理解植物响应逆境的分子机制,并最终将植物的抗逆性研究应用于生产实践中以解决粮食安全问题。
参考文献:1. Apel K, Hirt H. Reactive oxygen species: metabolism, oxidative stress, and signal transduction.[J]. Annual Review of Plant Biology, 2004, 55(1): 373-399. 2. Arshad M, Farooq M, Asch F, et al. Thermal stress impacts reproductive development and grain yield in rice[J]. Plant Physiology and Biochemistry, 2017: 57-72.3. Choi W, Toyota M, Kim S, et al. Salt stress-induced Ca2+ waves are associated with rapid, long-distance root-to-shoot signaling in plants[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(17): 6497-6502.4. *Christmann A, Grill E, Huang J, et al. Hydraulic signals in long-distance signaling[J]. Current Opinion in Plant Biology, 2013, 16(3): 293-300.5. *Christmann A, Weiler E W, Steudle E, et al. A hydraulic signal in root-to-shoot signalling of water shortage[J]. Plant Journal, 2007, 52(1): 167-174.6. Dempsey D M, Klessig D F. SOS–too many signals for systemic acquired resistance?[J]. Trends in Plant Science, 2012, 17(9): 538-545.7. *Devireddy A R, Zandalinas S I, Gomezcadenas A, et al. Coordinating the overall stomatal response of plants: Rapid leaf-to-leaf communication during light stress[J]. Science Signaling, 2018, 11(518).8. Dietz K J , Mittler R , Noctor G. Recent Progress in Understanding the Role of Reactive Oxygen Species in Plant Cell Signaling[J]. Plant physiology, 2016, 171(3):1535-1539.9. Endo A, Sawada Y, Takahashi H, et al. Drought Induction of Arabidopsis 9-cis-Epoxycarotenoid Dioxygenase Occurs in Vascular Parenchyma Cells[J]. Plant Physiology, 2008, 147(4): 1984-1993.10. Endo S, Betsuyaku S, Fukuda H. Endogenous peptide ligandreceptor systems for diverse signaling networks in plants. Curr Opin Plant Biol ,2014, 21:140-146.11. Farmer E E, Gasperini D, Acosta I F, et al. The squeeze cell hypothesis for the activation of jasmonate synthesis in response to wounding[J]. New Phytologist, 2014, 204(2): 282-288.12. Ferguson B J , Mens C , Hastwell A H , et al. Legume nodulation: The host controls the party.[J]. Plant Cell & Environment, 2018.13. Glauser G, Dubugnon L, Mousavi S A, et al. Velocity Estimates for Signal Propagation Leading to Systemic Jasmonic Acid Accumulation in Wounded Arabidopsis[J]. Journal of Biological Chemistry, 2009, 284(50): 34506-34513.14. Hirayama T, Shinozaki K. Perception and transduction of abscisic acid signals: keys to the function of the versatile plant hormone ABA. Trends Plant Sci ,2007, 12:343-351.15. *Holbrook N M, Shashidhar V R, James R A, et al. Stomatal control in tomato with ABA‐deficient roots: response of grafted plants to soil drying[J]. Journal of Experimental Botany, 2002, 53(373): 1503-1514.16. Huang S , Van Aken O , Schwarzl Nder M , et al. Roles of mitochondrial reactive oxygen species in cellular signalling and stress response in plants[J]. Plant Physiology, 2016: pp.00166.2016. 17. *Iuchi S, Kobayashi M, Taji T, et al. Regulation of drought tolerance by gene manipulation of 9‐cis‐epoxycarotenoid dioxygenase, a key enzyme in abscisic acid biosynthesis in Arabidopsis[J]. Plant Journal, 2001, 27(4): 325-333.18. Juvany M, Muller M, Munnebosch S, et al. Photo-oxidative stress in emerging and senescing leaves: a mirror image [J]. Journal of Experimental Botany, 2013, 64(11): 3087-3098.19. Kachroo A, Robin G P. Systemic signaling during plant defense[J]. Current Opinion in Plant Biology, 2013, 16(4): 527-533.20. Kudla J, Becker D, Grill E, Hedrich R, Hippler M, Kummer U, Parniske M, Romeis T, Schumacher K. Advances and current challenges in calcium signaling. New Phytol, 2018, 218:414-43121. Kuromori T, Seo M, Shinozaki K.ABA Transport and Plant Water Stress Responses. Trends Plant Sci ,2018, 23:513-522.22. Kwaaitaal M, Huisman R, Maintz J, Reinstadler A, Panstruga R. Ionotropic glutamate receptor (iGluR)-like channels mediate MAMP-induced calcium influx in Arabidopsis thaliana. Biochem J, 2011, 440:355-365.23. Lacombe B, Becker D, Hedrich R, et al. The Identity of Plant Glutamate Receptors[J]. Science, 2001, 292(5521): 1486-1487.24. Lam H, Chiu J C, Hsieh M, et al. Glutamate-receptor genes in plants.[J]. Nature, 1998, 396(6707): 125-126.25. Lewis B D, Karlin-Neumann G, Davis R W, et al. Ca2+- activated anion channels and membrane depolarizations induced by blue light and cold in Arabidopsis seedlings[J]. Plant Physiol, 1997, 114(4):1327-1334.26. Ma X, Wang W, Bittner F, et al. Dual and Opposing Roles of Xanthine Dehydrogenase in Defense-Associated Reactive Oxygen Species Metabolism in Arabidopsis[J]. The Plant Cell, 2016, 28(5): 1108-1126.27. Meyerhoff O, Müller K, Roelfsema M R, et al. AtGLR3.4, a glutamate receptor channel-like gene is sensitive to touch and cold[J]. Planta, 2005, 222(3):418-427.28. Mittler R , Vanderauwera S , Gollery M , et al. Reactive oxygen gene network of plants[J]. Trends in Plant Science, 2004, 9(10):0-498.29. Mittler R, Blumwald E. The Roles of ROS and ABA in Systemic Acquired Acclimation[J]. The Plant Cell, 2015, 27(1): 64-70.30. Nakaminami K, Okamoto M, Higuchitakeuchi M, et al. AtPep3 is a hormone-like peptide that plays a role in the salinity stress tolerance of plants[J]. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(22).31. Nakashima K, Yamaguchi-Shinozaki K, Shinozaki K. The transcriptional regulatory network in the drought response and its crosstalk in abiotic stress responses including drought, cold, and heat. Front Plant Sci ,2014, 5:170.32. *Nguyen CT, Kurenda A, Stolz S, Chetelat A, Farmer EE. Identification of cell populations necessary for leaf-to-leaf electrical signaling in a wounded plant. Proc Natl Acad Sci USA ,2018, 115:10178-10183.33. *Nishida H, Suzaki T. Nitrate-mediated control of root nodule symbiosis. Curr Opin Plant Biol ,2018, 44:129-136.34. Noctor G , Reichheld J P , Foyer C H . ROS-related redox regulation and signaling in plants[J]. Seminars in Cell & Developmental Biology, 2017.35. *Oh E, Seo P J, Kim J, et al. Signaling Peptides and Receptors Coordinating Plant Root Development[J]. Trends in Plant Science, 2018, 23(4): 337-351.36. *Ohkubo Y, Tanaka M, Tabata R, Ogawa-Ohnishi M, Matsubayashi Y. Shoot-to-root mobile polypeptides involved in systemic regulation of nitrogen acquisition. Nat Plants ,2017,3:17029.37. *Okamoto S, Tabata R, Matsubayashi Y. Long-distance peptide signaling essential for nutrient homeostasis in plants. Curr Opin Plant Biol ,2016, 34:35-40.38. Qi Z, Stephens N R, Spalding E P. Calcium entry mediated by GLR3.3, an Arabidopsis glutamate receptor with a broad agonist profile[J]. Plant Physiology, 2006, 142(3):963-971.39. Rodrigomoreno A, Bazihizina N, Azzarello E, et al. Root phonotropism: Early signalling events following sound perception in Arabidopsis roots[J]. Plant Science, 2017: 9-15.40. *Roy S J, Gilliham M, Berger B, et al. Investigating glutamate receptor-like gene co-expression in Arabidopsis thaliana[J]. Plant, Cell and Environment, 2008, 31(6):861-871.41. *Ruffel S, Gojon A. Systemic nutrient signalling: On the road for nitrate[J]. Nature plants, 2017, 3(4).42. Shah J, Zeier J. Long-distance communication and signal amplification in systemic acquired resistance[J]. Frontiers in Plant Science, 2013: 30-30.43. Suzuki N, Miller G, Salazar C, et al. Temporal-Spatial Interaction between Reactive Oxygen Species and Abscisic Acid Regulates Rapid Systemic Acclimation in Plants[J]. The Plant Cell, 2013, 25(9): 3553-3569.44. *Takahashi F, Suzuki T, Osakabe Y, et al. A small peptide modulates stomatal control via abscisic acid in long-distance signalling[J]. Nature, 2018, 556(7700).45. Tapken D, Hollmann M. Arabidopsis thaliana glutamate receptor ion channel function demonstrated by ion pore transplantation[J]. Mol Biol, 2008, 383 (1):36-48. 46. Tombesi S, Nardini A, Frioni T, Soccolini M, Zadra C, Farinelli D, Poni S, Palliotti A: Stomatal closure is induced by hydraulic signals and maintained by ABA in drought-stressed grapevine. Scientific reports 2015, 5:12449.47. *Toyota M, Spencer D, Sawai-Toyota S, Jiaqi W, Zhang T, Koo AJ, Howe GA, Gilroy S. Glutamate triggers long-distance, calciumbased plant defense signaling. Science ,2018, 361:1112-1115.48. Wang C, Elshetehy M, Shine M B, et al. Free Radicals Mediate Systemic Acquired Resistance[J]. Cell Reports, 2014, 7(2): 348-355.49. Yamauchi T, Yoshioka M, Fukazawa A, et al. An NADPH Oxidase RBOH Functions in Rice Roots during Lysigenous Aerenchyma Formation under Oxygen-Deficient Conditions[J]. The Plant Cell, 2017, 29(4): 775-790.50. Yang C, Li W, Cao J, et al. Activation of ethylene signaling pathways enhances disease resistance by regulating ROS and phytoalexin production in rice[J]. Plant Journal, 2017, 89(2): 338-353.51. Yoshida T, Fernie AR. Remote control of transpiration via ABA. Trends Plant Sci ,2018, 23:755-758.52. Yuan F, Yang H, Xue Y, Kong D, Ye R, Li C, Zhang J, Theprungsirikul L, Shrift T, Krichilsky B et al. OSCA1 mediates osmotic-stress-evoked Ca2+ increases vital for osmosensing in Arabidopsis. Nature ,2014, 514:367-371.
来源:frontiersin 植物科学最前沿
原文链接:https://mp.weixin.qq.com/s?__biz=MzIyOTY2NDYyNQ==&mid=2247500853&idx=4&sn=93b353949206cff9edf53e12b0398cf5&chksm=e8bdb62bdfca3f3d41aab5cd678c30c71cfb74a500394f7461a88049abf8a46379e03d426ea2#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn