来源:生物谷
在一项新的研究中,来自英国弗朗西斯-克里克研究所的研究人员发现位于SARS-CoV-2冠状病毒表面上的刺突蛋白(S蛋白)与人类病毒受体ACE2接触时,可以采取至少十种不同的结构状态。这种对感染机制的新见解为开发疫苗和治疗方法奠定基础。相关研究结果于2020年9月17日在线发表在Nature期刊上,论文标题为“Receptor binding and priming of the spike protein of SARS-CoV-2 for membrane fusion”。
图片来自The Francis Crick Institute。
作为引起新冠肺炎(COVID-19)的冠状病毒,SARS-CoV-2的表面覆盖着S蛋白,这使得这种病毒能够感染人体细胞。当S蛋白与细胞表面受体ACE2结合,并在随后阶段催化病毒基因组释放到细胞中时,感染就开始了。然而,ACE2与SARS-CoV-2的S蛋白结合的确切性质仍然未知。
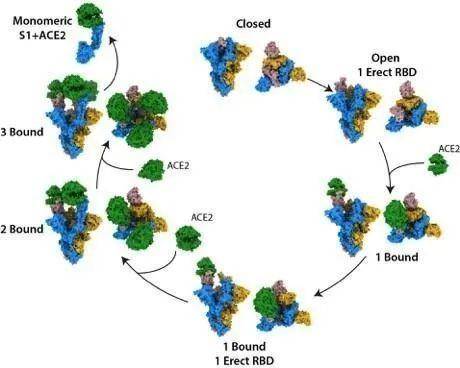
在首次对ACE2与S蛋白之间的结合机制进行整体考察的研究中,这些研究人员,对S蛋白与受体结合和感染的不同阶段相关的10种不同结构进行了表征。他们首先孵育S蛋白和ACE2的混合物,然后通过在液态乙烷中快速冷冻,捕捉不同形式的S蛋白。他们使用低温电镜技术检查这些蛋白样品,获得了数万张不同结合阶段的高分辨率图像。
他们观察到,S蛋白是以封闭和开放结构的混合物存在的。在ACE2结合一个开放位点后,S蛋白变得更加开放,导致一系列有利的构象变化,从而为进一步的结合做好准备。一旦S蛋白在所有三个结合位点上与ACE2结合,它的中央核心就会暴露出来,这可能有助于SARS-CoV-2与细胞膜融合,使得感染得以发生。
论文共同通讯作者Donald Benton说,“通过从整体角度研究结合事件,我们能够描述SARS-CoV-2特有的S蛋白结构。我们可以观察到,当S蛋白变得更加开放时,这种蛋白的稳定性会降低,这可能会增加它进行膜融合的能力,从而允许感染发生。”
这些研究人员表示,他们越能发现SARS-CoV-2与其他冠状病毒的不同之处,就能更有针对性地开发新的治疗方法和疫苗。
论文共同通讯作者Antoni Wrobel说,“随着我们揭开感染最早阶段的机制,我们可能会暴露出新的治疗靶点,或者了解目前现有的哪些抗病毒疗法更有可能发挥作用。”
论文共同通讯作者Steve Gamblin说,“我们对SARS-CoV-2还有很多不了解的地方,但它的基本生物学包含了控制这种流行病的线索。通过了解是什么使这种病毒与众不同,我们就可以得出其可利用的弱点。”
这些研究人员正在继续研究SARS-CoV-2和其他物种中相关冠状病毒的S蛋白结构,以更好地了解病毒感染和进化的机制。
参考资料:
1.Donald J. Benton et al. Receptor binding and priming of the spike protein of SARS-CoV-2 for membrane fusion. Nature, 2020, doi:10.1038/s41586-020-2772-0.
2.Scientists uncover the structural mechanism of coronavirus receptor binding
https://medicalxpress.com/news/2020-09-scientists-uncover-mechanism-coronavirus-receptor.html
来源:BIOONNEWS 生物谷
原文链接:http://mp.weixin.qq.com/s?__biz=MzI2NjY1NjA5Mw==&mid=2247515189&idx=5&sn=06248c5f485b37b6d80d9bd67d33b2b9&chksm=ea883c07ddffb51141ca779654216d8544455b235c4d7e4b7630c9aeebd38dc667fc45f043f7&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



