来源:BioArt
外泌体存在于各种生物体液中,通过其携带的蛋白质、核酸、脂质和代谢物等来发挥细胞间通讯功能,参与免疫应答、病毒感染、代谢和心血管疾病、神经退行性疾病以及癌症进展等多种生理和病理过程【1】。在内体转变为成熟多囊泡内体(multivesicular endosomes, MVEs)的过程中,内体膜向腔内出芽形成腔内囊泡(intraluminal vesicles, ILVs),MVEs与细胞膜融合释放ILVs到细胞外,即形成外泌体【2】。目前认为内体膜出芽形成ILVs主要通过转运必需内体分选复合体(endosomal sorting complex required for transport, ESCRT),许多熟知的货物蛋白,如蛋白多糖syndecan, 四次跨膜蛋白CD63, 以及 Toll样受体转运伴侣 UNC93B1等,通过细胞质侧的尾巴招募Syntenin-Alix-ESCRT-III通路介导它们的ILVs形成【2,3】。虽然ESCRT一直被认为是ILV形成所必需的,然而在ESCRT缺失的细胞中,仍然可以观察到MVEs内部存在ILVs,表明细胞中存在ESCRT非依赖的ILV形成方式【4】。
2020年9月22日,中山大学肿瘤防治中心康铁邦团队在Cell Research发文题为RAB31 marks and controls an ESCRT-independent exosome pathway,鉴定到一条由RAB31标记并控制的ESCRT非依赖的外泌体通路,极大地提升了我们对外泌体生物发生的认识和理解。

外泌体的生物发生途径主要包括三个关键的检查点:ILV的形成,阻止MVEs的降解以及MVEs和细胞膜的融合,这三个检查点都包含在内体相关的囊泡运输过程中【2】。RAB GTPase定位到特定膜结构的表面,通过招募效应因子来调节相应膜结构的囊泡运输【5】,例如,在内体溶酶体运输网络中,RAB5调节早期内体的形成及相互融合;内体膜上RAB5到RAB7的转换调节早期向晚期内体的转变;RAB7调节晚期内体/MVEs与溶酶体的融合来降解ILVs;RAB27调节MVEs与细胞膜的对接和融合来释放ILVs形成外泌体。内吞的膜蛋白,特别是受体酪氨酸激酶(receptor tyrosine kinase, RTK)家族的表皮生长因子受体(epidermal growth factor receptor, EGFR),定位到内体和MVEs,通过MVEs和溶酶体融合来进入溶酶体降解,此过程受多种RAB GTPases和ESCRT复合体的调控【6】。ESCRT分选泛素化的EGFR进入MVEs形成ILVs来促进EGFR的溶酶体降解,是MVE通路上膜蛋白分选进入内体溶酶体降解的经典模型。事实上,EGFR在多种癌症中经常积累并伴随着突变,并且存在于癌细胞系和癌症病人血清来源的外泌体中。这个现象表明分选EGFR进入ILVs走向外泌体分泌的通路可能不同于ESCRT复合体,体现在ILV形成和阻止MVE降解这两个关键检查点,极有可能受RAB GTPase的调控。
为了找到控制EGFR外泌体形成的RAB GTPase,研究团队首先构建了一个由62个RAB GTPases组成的激活型RAB GTPase文库,在正常培养条件下的HeLa细胞中,利用免疫荧光筛选到激活型RAB31 (RAB31Q65L)指导EGFR定位到膨大的CD63阳性MVEs (图1)。研究团队进一步发现在血清饥饿条件下,非泛素化的EGFR依然会内吞进入细胞,而RAB31Q65L驱动内吞的EGFR定位到膨大的CD63阳性MVEs而不进入溶酶体。结构化照明显微镜(SIM)和3D-SIM的结果显示RAB31Q65L和EGFR进入CD63阳性MVEs内部并定位到ILVs结构,免疫电镜的结果清晰地显示它们定位到ILV的膜结构上(图1)。进一步地,研究团队发现RAB31Q65L显著增加浓缩条件培养基(concentrated conditional media, CCM)中的EGFR(图1),以及一些熟知的EV标记物,如FLOT1、 FLOT2、CD9、CD81和CD63,但是ESCRT相关的EV标记物,如Tsg101和Alix,并没有改变,暗示ESCRT可能不参与RAB31Q65L驱动的EGFR外泌体的形成。确实,研究团队进一步通过敲降ESCRT组分Hrs和Tsg101,以及相关蛋白Alix,证明它们不参与RAB31Q65L驱动的EGFR外泌体的形成。因此,研究团队提出激活型RAB31标记并控制一条ESCRT非依赖的外泌体通路。
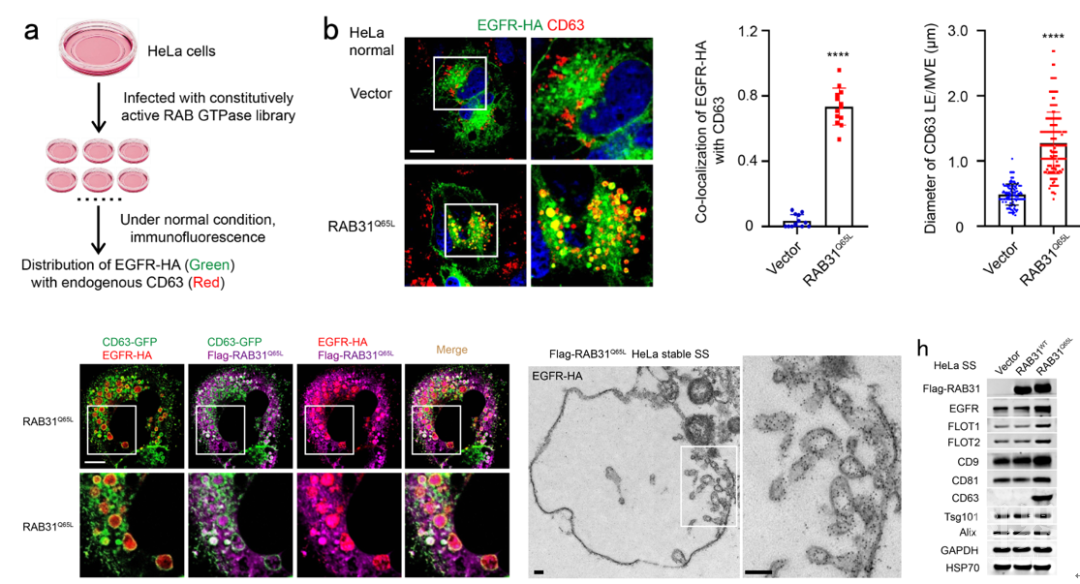
图1 RAB31Q65L驱动EGFR进入MVEs形成ILVs和外泌体
进一步,研究团队对RAB31Q65L驱动EGFR外泌体形成的效应因子和机制进行探究。值得注意的是,作为内体膜和细胞膜的脂筏结构蛋白FLOT1和FLOT2,同时也作为经典的EV标记物,在RAB31Q65L来源的CCM中高度富集。通过一系列基因敲降、抑制剂处理、免疫荧光和外泌体组分分析,研究团队发现FLOTs是RAB31Q65L驱动EGFR外泌体形成的效应因子,脂筏结构的组分胆固醇和神经酰胺是RAB31Q65L-FLOTs诱导MVE膜出芽形成ILVs所必需的。通过截短回补实验,研究团队发现激活型RAB31结合FLOTs的SPFH结构域并通过Flotillin结构域来诱导MVEs膜出芽形成ILVs。
进一步,研究团队对激活RAB31的上游调控信号进行探寻。血清饥饿条件下,RAB31WT只能指导EGFR定位到晚期内体的膜上,而不进入MVEs内部。有趣的是,EGF刺激可以促进RAB31WT和EGFR进入CD63阳性MVEs内部,同时促进EGFR外泌体的产生。接着,研究团队发现EGFR通过磷酸化RAB31的Y76、Y86和Y137三个位点的酪氨酸,使其具有和激活型RAB31Q65L相同的功能。这三个酪氨酸位点的突变体RAB313YF不能驱动EGFR进入MVEs内部,同时显著减少EGFR外泌体的产生。研究团队进一步发现多种RTKs可以通过磷酸化RAB31使其转变为激活型,接着激活型RAB31通过脂筏微结构域中的FLOTs驱动这些RTKs进入MVEs形成ILVs及相应的外泌体。进一步,研究团队通过对CCM中外泌体蛋白组分的检测和分析来比较两条外泌体通路的关系,发现RAB31-FLOTs和Syntenin-Alix-ESCRT-III通路是两条平行的外泌体形成通路,分别负责不同的货物。
最后,研究团队对RAB31能否阻止MVEs的降解进行探究。在EGF刺激条件下,通过免疫荧光和免疫印迹追踪EGFR的定位和降解,发现外源表达的RAB31可以将EGFR阻滞在CD63阳性MVEs而不进入溶酶体,即RAB31通过抑制MVEs和溶酶体融合来阻止EGFR的溶酶体降解。因为MVEs和溶酶体融合由激活型RAB7介导,研究团队推测高表达的RAB31会抑制RAB7的活性。通过检测细胞中激活型RAB7的水平和定位,研究团队证实外源表达的RAB31会显著降低细胞中激活型RAB7的水平,而且RAB31定位的晚期内体和MVEs表面没有激活型RAB7的分布。进一步,研究团队发现RAB31招募GTP酶激活蛋白(GTPase-activating protein, GAP) TBC1D2B到晚期内体/MVEs表面来失活RAB7。此外,内源RAB31的敲降不仅会导致TBC1D2B不再定位到晚期内体/MVEs,而且会显著地提升细胞中激活型RAB7的水平。
总的来说,该研究揭示了RAB31在外泌体生物发生过程中的双重功能:驱动ILVs的形成和阻止MVEs的降解。多种RTKs通过磷酸化来激活RAB31,激活型RAB31通过结合脂筏微结构域中的FLOTs蛋白驱动MVEs膜出芽形成ILVs,同时RAB31招募TBC1D2B到MVEs表面失活RAB7来抑制MVEs和溶酶体的融合,从而有利于MVEs和细胞膜融合释放ILVs形成外泌体(图2)。此外,该研究对外泌体生物发生相关分子机器的重新梳理和定义,为更好地理解外泌体生物发生的复杂异质性迈出了关键一步。对RAB31相关分子机器的深入理解,可为多种人类疾病(如癌症和神经退行性疾病等)治疗策略的设计提供重要的理论基础。

图2 RAB31标记并控制外泌体通路的作用模式图
据悉,中山大学肿瘤防治中心魏灯辉助理研究员、詹伟祥博士和高瑛博士为共同第一作者;中山大学肿瘤防治中心康铁邦教授为通讯作者。
专家点评
史岸冰(华中科技大学同济基础医学院教授)
早在1967年,Peter Wolf 就发现血小板周围颗粒状物质的存在,当时称其为 “platelet dust” 。直至上世纪80年代,科学家们发现了另外一种细胞外囊泡,也就是外泌体,才掀起细胞外囊泡研究的热潮。细胞外囊泡大致分为两种,一种质膜直接包裹细胞内容物而释放到胞外(microvesicle,100-1000nm),另一种则是通过胞吞和胞吐以及膜融合的过程释放的颗粒状物质(exosome, 30-100nm)。大量的研究已经表明,细胞外囊泡(extracellular vesicles, EVs)内含大量的生物活性物质,包括蛋白质,脂类,糖类和核酸类等,在细胞间进行信息传递,而其中以外泌体的研究尤为突出,但在外泌体的形成过程中,其复杂的生物学过程仍不十分清晰。中山大学肿瘤防治中心康铁邦团队在Cell Research发文题为RAB31 marks and controls an ESCRT-independent exosome pathway的论文,该研究首次报道RAB31介导了非内体分选复合体(endosomal sorting complex required for transport, ESCRT)依赖的exosome分选和释放机制。该研究通过62个RAB GTPases组成的激活型RAB GTPase文库,筛选出RAB31可以促进EGFR在多囊泡内体(multivesicular endosomes, MVEs)中的富集,且阻止其进入溶酶体,为后期腔内囊泡(intraluminal vesicles, ILVs)的形成提供有力条件。此外,本研究还通过外泌体标记物的筛选预测RAB31介导的此条通路为ESCRT非依赖的,且敲降ESCRT组分Hrs和Tsg101,以及相关蛋白Alix的结果也验证了这一推测。
本研究除了筛选出全新的RAB31-FLOTs外泌体形成通路外(完全独立和平行于Syntenin-Alix-ESCRT-III通路),对这一类全新的膜泡分选运输机制也进行了详细的分子水平层面的探究:通过突变体的研究反证发现RAB31的Y76、Y86和Y137三个位点的酪氨酸磷酸化是其发挥激活性GTPase功能的关键位点。此外,本文的另一亮点则是发现RAB31激活后通过招募GTP酶激活蛋白(GTPase-activating protein, GAP) TBC1D2B到晚期内体/MVEs表面来失活RAB7,进而阻止MVEs和溶酶体的融合。除去基本的生物学过程阐述外,本研究也有着重要的临床转化意义。EGFR酪氨酸激酶的突变是众多肺癌的的驱动基因,临床上已经通过针对这些靶点的酪氨酸激酶的抑制剂(Tyrosine Kinase Inhibitor,TKI)来治疗肺癌,且取得了不错的疗效,但EGFR的持续突变以及相关的耐药机制仍难以得到解决。前期研究已经表明外泌体介导的EGFR的细胞间穿梭促进肿瘤的进展,本文从囊泡筛选和运输的角度详细描述了这一过程,为后续的针对EGFR的精准靶向治疗提供了潜在的靶点。
参考文献
1. R. Kalluri, V. S. LeBleu, The biology, function, and biomedical applications of exosomes. Science 367, 6977 (2020).
2. G. van Niel, G. D'Angelo, G. Raposo, Shedding light on the cell biology of extracellular vesicles. Nature reviews. Molecular cell biology 19, 213-228 (2018).
3. M. F. Baietti et al., Syndecan-syntenin-ALIX regulates the biogenesis of exosomes. Nature cell biology 14, 677-685 (2012).
4. S. Stuffers, C. Sem Wegner, H. Stenmark, A. Brech, Multivesicular endosome biogenesis in the absence of ESCRTs. Traffic 10, 925-937 (2009).
5.H. Stenmark, Rab GTPases as coordinators of vesicle traffic. Nature reviews. Molecular cell biology 10, 513-525 (2009).
6. C. Raiborg, H. Stenmark, The ESCRT machinery in endosomal sorting of ubiquitylated membrane proteins. Nature 458, 445-452 (2009).
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652500379&idx=4&sn=1b1587d3eefe9a7d3b84003bfcee819a&chksm=84e2622fb395eb39bec318d560221b1fd6fb55d2a02c3046cf83346788e105c216963e78906d#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



