病毒学国际学术期刊Journal of Virology 近期在线发表了生物安全大科学中心/中国科学院武汉病毒研究所肖庚富团队的最新研究成果,论文题为Comprehensive Interactome Analysis Reveals that STT3B is Required for the N-Glycosylation of Lassa Virus Glycoprotein。该工作揭示了寡糖转移酶STT3B在拉沙病毒囊膜糖蛋白N-糖基化过程中的功能和作用机制。
哺乳动物沙粒病毒(Mammarenavirus)属于布尼亚病毒目(Bunyavirales)沙粒病毒科(Arenaviridae),主要由旧世界和新世界沙粒病毒组成,包括多种对人类有重要威胁的烈性病毒,例如拉沙热病毒(Lassa virus,LASV)、鸠宁病毒(Junín virus,JUNV)、马秋波病毒(Machupo virus,MACV)等。其中LASV主要在尼日利亚、利比里亚、塞拉利昂、几内亚等西非国家中流行,每年造成10-30万人感染,约5000人死亡。LASV囊膜糖蛋白GP高度糖基化,在其躲避宿主抗体中和过程中起重要作用,但是其糖基化过程的具体机制仍不明确。该研究利用质谱技术对LASV GP蛋白的互作宿主蛋白进行鉴定,发现宿主寡糖转移酶(OST)复合物中STT3B和LASV GP蛋白存在较强互作。哺乳动物细胞内OST复合物的催化亚基存在STT3A和STT3B两种亚型,通常情况下,STT3B型OST负责补充STT3A遗漏的N-糖基化位点。该研究发现,LASV GP蛋白部分N-糖基化位点主要不是由STT3A而是由STT3B型OST介导,STT3B协同其辅助蛋白MAGT1或TUSC3在LASV GP蛋白N-糖基化及其随后成熟过程中发挥更重要的作用。该研究还发现这种现象在JUNV、MACV等其他高致病性沙粒病毒中普遍存在。此外,对STT3B的特异性比STT3A高的N-糖基化抑制剂NGI-1能够显著抑制LASV等一系列高致病性沙粒病毒GP蛋白糖基化过程并降低病毒感染力。该研究为今后深入解析LASV等沙粒病毒的感染机理以及抗病毒药物的研发提供了候选靶标。
武汉病毒所博士生朱圣淋为该论文的第一作者,研究员肖庚富和副研究员张磊砢是该论文的共同通讯作者。该工作得到国家重点研发计划、国家自然科学基金和中科院青年创新促进会项目的资助。
文章链接
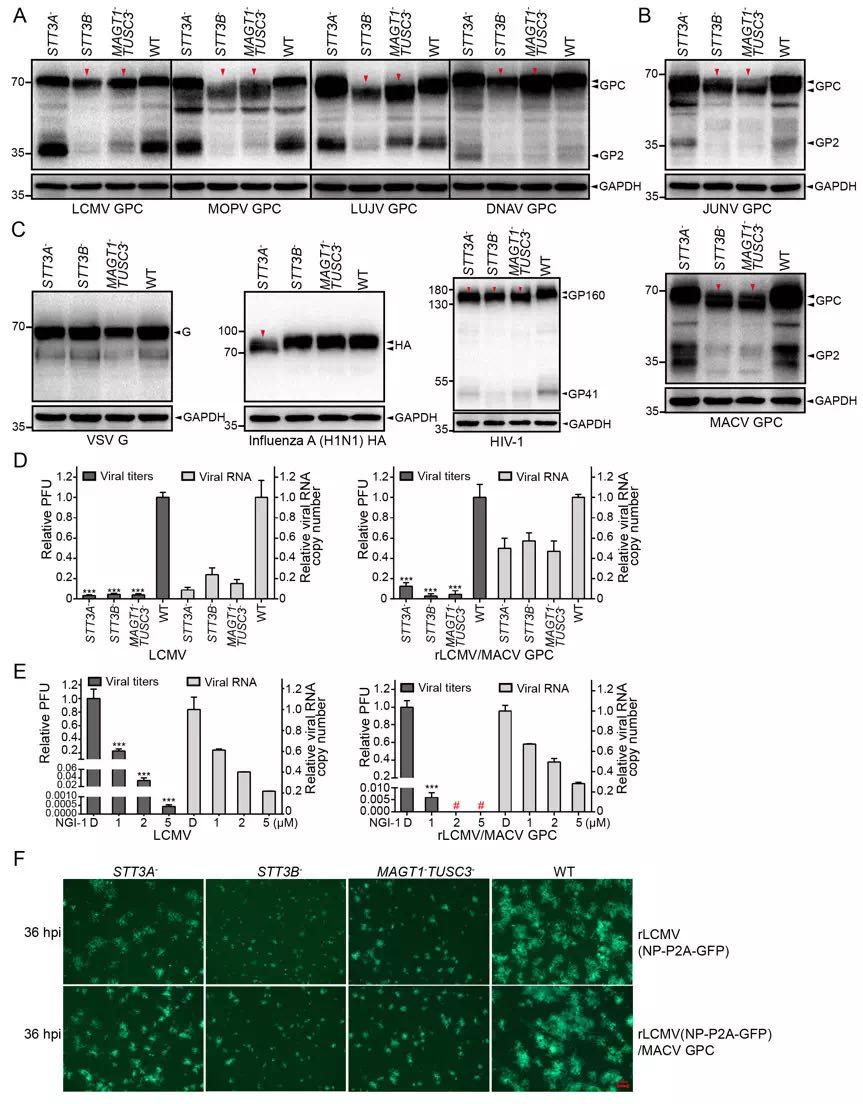
图示:STT3B协同其辅助蛋白MAGT1或TUSC3在LASV 等高致病性沙粒病毒GP蛋白N-糖基化及随后成熟过程中发挥重要作用
内容来源:中国科学院来源:中国科学院
原文链接:http://www.cas.cn/syky/201910/t20191014_4720063.shtml
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn