来源:iNature
CRISPR/Cas系统是细菌和古菌特有的免疫系统,是生命进化历史上,细菌和病毒进行斗争产生的免疫武器,用于抵抗病毒或外源性质粒的侵害。当外源基因入侵时,该防御系统的 CRISPR 序列会表达与入侵基因组序列相识别的 RNA,然后 CRISPR 相关蛋白(Cas,一种核酸内切酶)在序列识别处切割外源基因组DNA,从而达到防御目的。
CRISPR技术是在20世纪90年代初发现的,并在7年后首次用于生物化学实验,在2013年2月15日,张锋等人将CRISPR/Cas9系统成功应用于哺乳动物和人类细胞的基因编辑,此后迅速成为人类生物学、农业和微生物学等领域最流行的基因编辑工具。
根据效应核酸酶组成的亚基数量,CRISPR/Cas系统可以分为两类:第一类系统的核酸酶由多个亚基组成;第二类系统特别受关注,其核酸酶由单一的蛋白组成,包括基于Cas9、Cas12和Cas13效应蛋白的II、V和VI型。其中,与大多数Cas蛋白不同,Ⅵ型系统的核酸酶Cas13是一种依赖于RNA靶向的RNA核酸酶,专一的切割RNA,不切割DNA,在分子诊断方面具有重要的应用价值。
世界上许多最常见或致命的人类病原体都是RNA病毒(例如埃博拉病毒,寨卡病毒,艾滋病病毒,流感病毒等),然而,这些病毒中只有2.5%具有可被Cas9靶向的DNA中间体,因此,使用RNA和DNA靶向的Cas9同源物显然不太可能满足这一需求,因为它们的RNA切割效率较低,并可能对细胞DNA产生脱靶效应。此外,这些致命的RNA病毒大多数没有FDA批准的治疗方法。因此,迫切需要开发新的抗病毒方法。
2019年10月10日,麻省理工学院和哈佛大学Broad研究所的Pardis C. Sabeti、张锋等人在 Cell 子刊 Molecular Cell 杂志发表了题为:Programmable Inhibition and Detection of RNA Viruses Using Cas13 的研究论文。
研究人员将Cas13的抗病毒活性与其诊断能力结合起来,建立了一个强大和快速可编程的诊断和抗病毒系统,命名为CARVER (Cas13辅助的病毒表达和读出限制),以检测和消灭人类细胞中基于RNA的病毒。该系统将来可能用于诊断和治疗病毒感染(包括由新病毒和新兴病毒引起的感染)。
注:CARVER,Cas13-assisted restriction of viral expression and readout,同时,CARVER也有雕刻师的意思。

此前,研究人员已经将Cas13酶用作切割和编辑人类RNA的工具,并将其作为检测病毒、细菌或其他靶标的诊断方法。这项研究是首次利用Cas13或任何CRISPR系统在培养的人类细胞中作为抗病毒药物的研究之一。
“人类的病毒病原体极其多样化,即使是单一种类的病毒,它们也在不断地适应环境,这凸显了灵活抗病毒平台的挑战和需求。而我们的工作便是将CARVER建立为一种强大且可快速编程的诊断和抗病毒技术,可用于对抗多种此类病毒。”霍华德·休斯医学研究所的Sabeti研究员表示。
在过去的50年里,已经有90种临床认可的抗病毒药物被生产出来,但它们只能治疗9种疾病——而病毒病原体可以迅速进化出对治疗的耐药性。目前,只有16种病毒有FDA批准的疫苗。
为了探索新的抗病毒策略,研究人员将重点放在了Cas13上,它可以天然地靶向细菌中的病毒RNA。该酶可被编程去靶向RNA的特定序列,几乎没有限制,并且相对容易进入细胞,而且,Cas13已由包括Broad 研究所核心成员张锋在内的研究人员在哺乳动物细胞中进行了充分研究。
研究人员首先筛选了一系列基于RNA的病毒,然后寻找Cas13可以有效靶向的病毒RNA序列。他们主要寻找的是那些既不易突变,又最有可能在被切断后使病毒失效的片段。最终,研究人员通过计算确定了数百个病毒物种中的数千个位点,这些位点可能是Cas13的有效靶标。
Myhrvold解释说:“理论上,你可以对Cas13进行编程,使其可以攻击病毒的任何部位。但物种内部和物种之间存在巨大的多样性,随着病毒的进化,很多基因组会迅速改变。如果不小心,你可能会靶向一个最终没有效果的目标。”
研究人员通过实验测试了Cas13在分别感染了三种不同RNA病毒的人类细胞中的活性:淋巴细胞性脉络丛脑膜炎病毒(LCMV)、甲型流感病毒(IAV)和疱疹性口炎病毒(VSV)。研究人员将Cas13基因片段和一种工程化的引导RNA导入细胞,24小时后,将细胞暴露在病毒中。再过24小时后,Cas13酶使细胞培养中的病毒RNA水平降低了多达40倍。
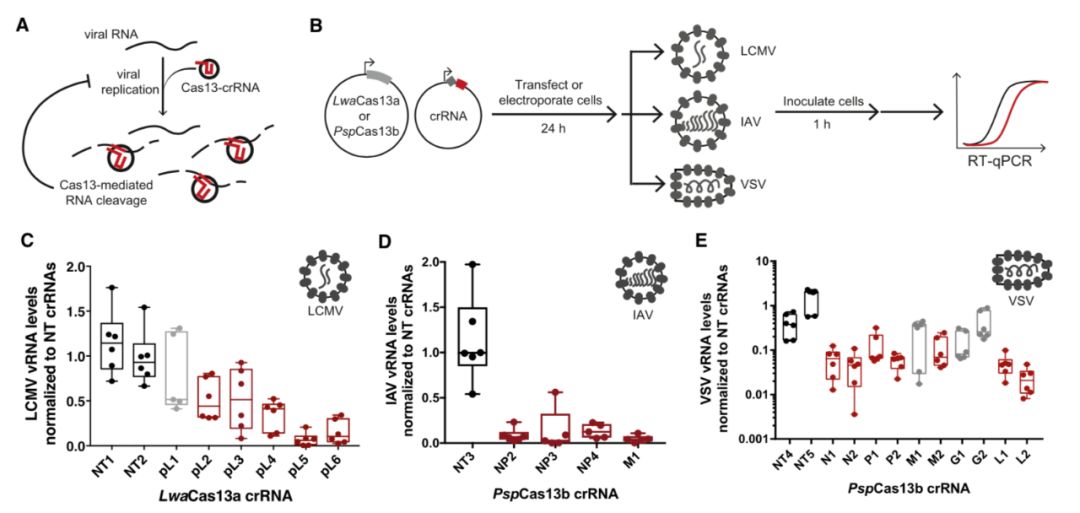
研究小组进一步研究了Cas13对病毒感染性的影响——换句话说,剩余的病毒有多少可以继续感染人类细胞。数据表明,在病毒暴露8小时后,Cas13将流感病毒的传染性降低了300多倍。
为了增加诊断需求,研究人员还采用了基于Cas13的核酸检测技术SHERLOCK(specifichigh-sensitivity enzymatic reporter unlocking)。这个三合一的CARVER系统可以快速测量样品中病毒RNA的剩余水平。
注:SHERLOCK,由张锋开发并命名,同时,SHERLOCK是神探夏洛克·福尔摩斯(Sherlock Holmes)的名字。张锋简直是起名大师,总是能把名字和功能结合的这么完美。
SHERLOCK术基于CRISPR/Cas13a系统,并结合重组聚合酶扩增技术(RecombinasePolymerase Amplification,RPA),能够对样本中痕量的核酸在恒温条件下进行大量扩增,从而满足Cas13a的检测需求。
SHERLOCK技术的快速发展,是张锋一手带领的,但是今天这项研究却并不是由张锋主导的,张锋是作者之一,本文的通讯作者其实是另一位读者可能不太熟悉的杰出科学家,同在Broad研究所任职的美女生物信息学家Pardis Sabeti。
当埃博拉病毒在西非开始流行的时候,Sabeti教授做了一件非常重要的事:她的团队几乎在疫情爆发第一时间就对来自感染者的病毒样本进行了测序,从DNA数据中清楚确定了病毒传播的途径。参与这项工作的许多科学家在这次疫情中感染死亡,但换回了更多生命。她因此被评为《时代周刊》2014年度人物,当之无愧的“埃博拉斗士”。

该研究的第一作者 Catherine Freije 表示:“Cas13可以是一种研究工具,来探索人类细胞中病毒生物学的许多方面,它也可能是一种临床工具,用于诊断样本,治疗病毒感染,并衡量治疗的有效性——所有这些都能让CARVER在新的或耐药性病毒出现时迅速适应和应对。”
参考内容:
https://doi.org/10.1016/j.molcel.2019.09.013
来源:Plant_ihuman iNature
原文链接:http://mp.weixin.qq.com/s?__biz=MzU3MTE3MjUyOA==&mid=2247504944&idx=4&sn=91fcce12086736c26675e43994297105&chksm=fce6a7efcb912ef95c44494b6674ab7d6c312fe23c0f140edb15e7b7d534d30d2596f15c57c0&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



