3月13日,清华大学生命学院陈柱成、李雪明课题组联合中科院物理所李明研究员等人在国际顶级学术期刊《自然》(Nature)上在线发表题为《Snf2介导的染色质重塑中DNA滑移机理的研究》(Mechanism of DNA translocation underlying chromatin remodeling by Snf2)的研究论文。该工作解析了不同核苷酸状态下Snf2-核小体复合物的冷冻电镜结构,揭示了染色质重塑的机理。
SWI/SNF家族蛋白利用ATP水解产生的能量移动核小体在基因组DNA的位置,重塑染色质。这对于控制遗传物质的开放性,调节基因转录等方面发挥重要作用。陈柱成实验室近期报道了Snf2与核小体结合的结构 (Liu, Nature 2017),但这个早期的工作并没有明确检测到DNA移位。染色质重塑蛋白如何利用ATP水解的能量推动核小体滑移依然是一个让人困扰的难题。
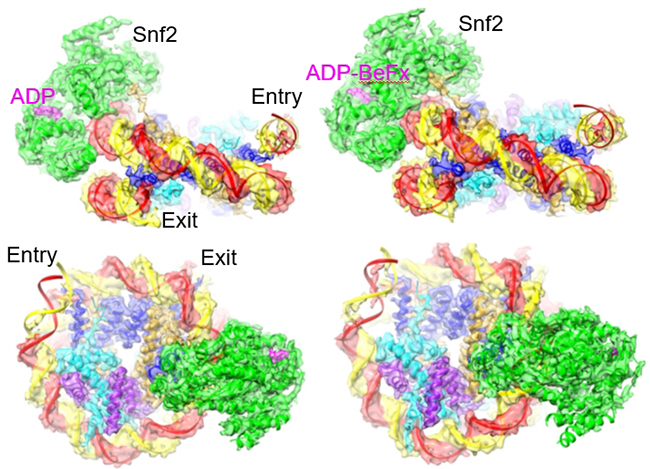
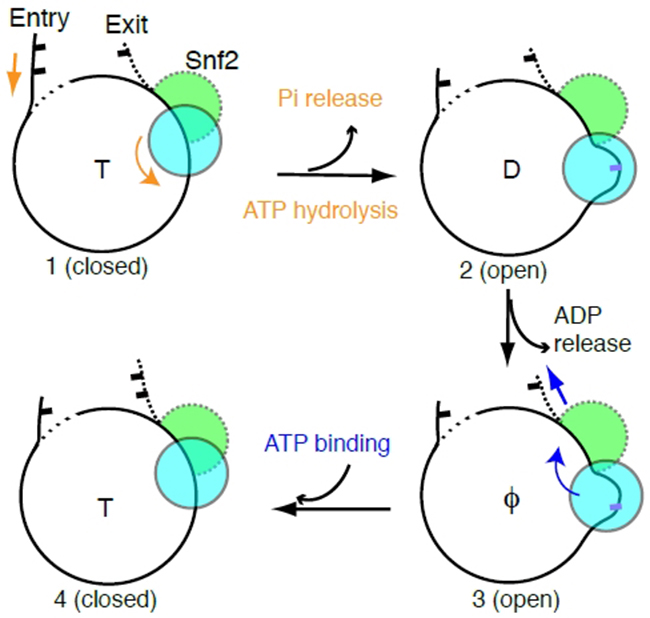
图1. Snf2-核小体复合物在不同核苷酸状态的整体结构以及核小体滑动模型
在这个研究基础上,陈柱成继续与李雪明实验室合作,利用冷冻电镜技术,进一步确定了在不同核苷酸(ADP和ADP-BeFx)状态下Snf2-核小体复合物的高分辨结构(图1)。他们发现在一个ATPase循环过程中,Snf2存在打开-闭合的构象变化。在打开状态下,Snf2在核小体结合点(SHL2)引起1bp DNA的凸起,这个形变沿DNA链向入口端传递,使得1bp DNA被拉入核小体。而且DNA前导链比后随链有更明显的移动,显示DNA的“扭曲-滑移”运动。ADP-BeFx的结合导致酶构象闭合,核小体恢复到自然状态,没有明显的扭曲。Snf2介导的这种DNA运动模式超出一般想象。
为了确认这些实验结果,陈柱成与中科院物理所李明实验室合作,利用单分子荧光技术(smFRET)确认了溶液状态的DNA运动与冷冻电镜结构一致。最后,研究者提出了染色质重塑的两步走”DNA波”模型:第一步,ATP水解,Snf2张开,把DNA从入口端拉进,并在SHL2处储存1bp DNA形变(“DNA波”);第二步,ATP结合,Snf2关闭,使得DNA形变向出口端传递,就像水波沿湖面传递一样,最终实现DNA对组蛋白的相对移动。这个模型表明Snf2水解一个ATP,移动1bp DNA。同时也解释了DNA移动的方向性机制。所以,本论文解答了染色质重塑过程中DNA移位的基本原理,相信此研究结果在染色质领域会有非常广泛的影响。
清华大学生命学院陈柱成研究员、李雪明研究员,中科院物理所李明研究员为本文共同通讯作者。清华大学生命学院博士生李美静、夏显、田元元和刘晓玉,中科院物理所博士生贾棋为本文共同第一作者。本课题由中国科技部,自然科学基金委提供经费支持,并得到清华-北大生命科学联合中心,北京市高精尖结构生物学中心的资助。
全文链接:
https://www.nature.com/articles/s41586-019-1029-2