Autophagy(《自噬》)杂志近日在线发表了生命科学学院宋质银教授课题组关于调控线粒体自噬新的分子机制的最新研究成果。
论文题为“PHB2 (prohibitin 2) promotes PINK1-PRKN/Parkin-dependent mitophagy by the PARL-PGAM5-PINK1 axis”(《PHB2通过PRAL-PGAM5-PINK1轴线促进PINK1-Parkin介导的线粒体自噬》)。武汉大学生命科学学院研究生闫朝君为第一作者,通讯作者为宋质银教授。
线粒体自噬是选择性的清除受损或者多余的线粒体,最终通过溶酶体降解。线粒体自噬的选择性需要自噬受体介导,目前已报到多种线粒体自噬受体包括OPTN、DNP52、FUNDC1、BNIP3等。这些受体定位在或者被募集到线粒体外膜上,而后与LC3II结合介导线粒体自噬。2017年Cell(《细胞》)杂志发表论文指出,线粒体内膜蛋白PHB2(prohibitin)能作为内膜受体招募LC3并介导PINK1-Parkin依赖性的线粒体自噬。但是PHB2是否参与调控PINK1-Parkin途径,以及线粒体内外膜受体如何协同调控线粒体自噬还不清楚。
PINK1是定位在线粒体内膜的蛋白,在正常的线粒体中,PINK1进入线粒体内膜会被线粒体蛋白酶PARL识别并剪切,随后PINK1被蛋白酶体降解。而在受损的线粒体中,PINK1会被稳定在线粒体外膜上,随后招募Parkin促进线粒体自噬。但是PINK1是如何从线粒体内膜转位到线粒体外膜上的机制还是空白。研究发现,PHB2可稳定线粒体内膜蛋白酶PARL,并阻止PARL对于PGAM5的剪切,完整的PGAM5可将PINK1稳定在线粒体外膜上,随后招募Parkin和线粒体其它受体如NDP52,促进线粒体自噬。
此外,宋质银课题组发现,与PHB2结合的小分子化合物FL3可通过抑制PHB2功能明显阻止PINK1-Parkin途径的线粒体自噬,并且具有抗肿瘤功效。该研究揭示了PHB2调节线粒体自噬的新的分子机制,而且发现了以PHB2为靶点通过阻止线粒体自噬来抑制肿瘤细胞的生存可作为一个新的抗癌策略。
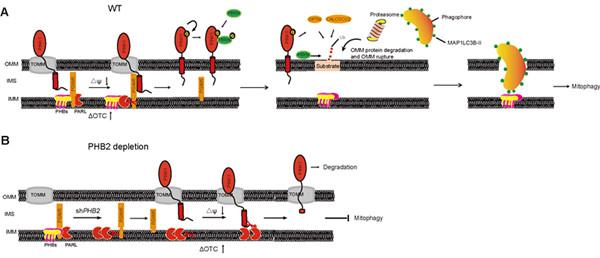
▲PHB2调控PINK1-Parkin途径的线粒体自噬分子机制模式图
论文链接:https://www.tandfonline.com/doi/full/10.1080/15548627.2019.1628520



