来源:BioArt
中性粒细胞是机体抵御外来病菌的第一道防线,但是,其异常募集却会导致多种脏器功能异常和严重病变【1】,脓毒症就是典型代表。在北美,每年因脓毒症而死亡的人数高达三百万至五百万【2】。而脓毒症所伴随的肺病,尤其是确诊为急性呼吸功能障碍,致死率更高【3】。
目前学界认为,经典的中性粒细胞从血液中募集至炎症部位(包括肌肉,皮肤,肠系膜等),是通过“选择素-PSGL-整合素”这一途径实现的,即内皮细胞所分泌的选择素作用于中性粒细胞上的选择素受体PSGL-1,实现中性粒细胞的旋转折叠。接下来,变形的中性粒细胞与整合素家族分子,比如CD18和CD11b紧密结合,被募集至病灶部位【4,5】。
但是,肝脏和肺脏却并非如此。在发炎的肝脏中,中性粒细胞并未发生卷曲折叠;而在肺脏中,即使选择素和整合素缺失或突变,中性粒细胞仍旧能够发生集结【6,7】。因此,中性粒细胞是如何被募集至肝脏和肺脏的这一问题,仍旧亟待解决。
2019年8月22日,来自加拿大卡尔加里大学的Donna Senger团队在Cell杂志发表名为Dipeptidase-1 Is an Adhesion Receptor for Neutrophil Recruitment in Lungs and Liver的文章,揭示了肝脏和肺脏中性粒细胞的募集机制。

作者首先构建了一个高效体内筛选体系,如下图所示,简单来说,作者建立了一个随机携带中性粒细胞遗传信息的噬菌体库,初步纯化后,注射入已清除中性粒细胞的脂多糖诱导的脓毒症小鼠体内。接下来,收集小鼠的肝脏和肺脏,寻找在肝脏和肺脏都大量出现的特殊噬菌体。最后,这些噬菌体经过富集之后,重新注入小鼠,从而筛选出可以特异抑制中性粒细胞聚集的噬菌体。
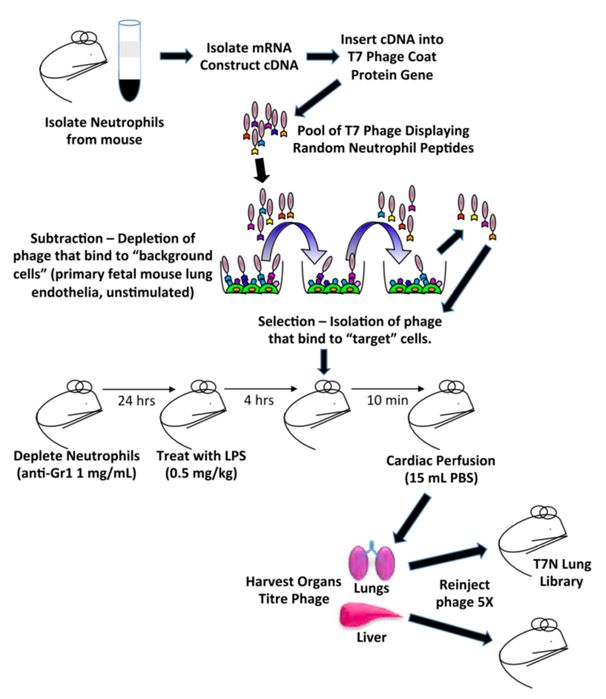
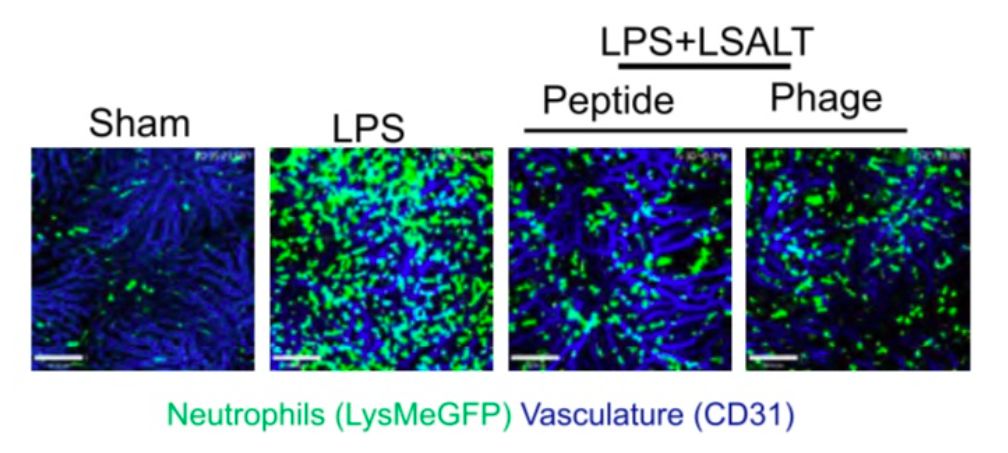
作者筛选出携带LSATL (H-LSALTPSPSWLKYKAL-NH2)多肽信息的噬菌体。如下图所示,无论是噬菌体本身,还是合成的其编码的多肽,都可以有效的抑制中性粒细胞在肝脏的聚集。肺脏也有同样 结果。
接下来,作者进一步研究多肽LSATL的作用机理。有报道指出,内皮细胞表面分子I型二肽酶(DPEP1)可以与肺脏中的多肽结合【8】,所以,作者首先检测,I型二肽酶是否也是LSATL的受体。研究发现,LSATL都可以和I型二肽酶发生明显的蛋白质相互作用。
与此同时,作者确认,DPEP1可以与中性粒细胞结合,并且,多肽LSALT可以降低二者的结合效率。
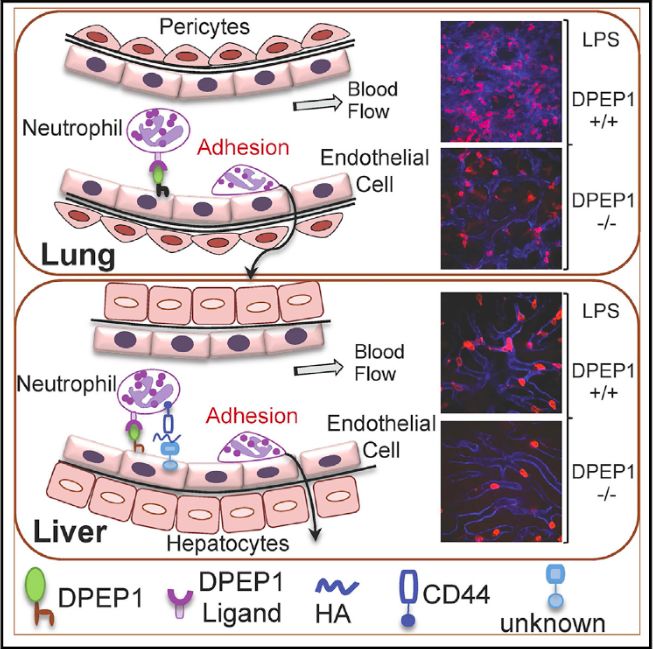
然后,作者想知道,二肽酶DPEP1与多肽LSATL之间的相互作用,或者是DPEP1结合中性粒细胞的功能,是否需要二肽酶的酶活性呢?作者采用二肽酶抑制剂和突变二肽酶酶活性区域两种方法,发现,DPEP1和中性粒细胞以及多肽LSATL的结合,不需要其二肽酶酶活性。也就是说,DPEP1在中性粒细胞募集过程中,是作为膜上的特异结合的粘附受体而存在的。
接下来,作者利用DPEP1敲除小鼠,进一步确认I型二肽酶的作用。作者发现,DPEP1敲除小鼠的肝脏和肺脏中,LPS诱导的脓毒症所导致的中性粒细胞聚集都大大减少。
最后,作者探究了中性粒细胞特异表达的多肽LSATL在临床上的可能性。同样采用LPS诱导的脓毒血症模型,作者发现,注射多肽LSATL的小鼠,其生存率大大升高,并且具有计量依赖性。这表明,LSATL以及其受体DPEP1,可以作为治疗和缓解脓毒症所引起的肝脏肺脏病变的药物研发靶点。
综上,如下图所示,作者发现,在肝脏和肺脏中,I型二肽酶同样也可以作为粘附受体而存在,并行使募集中性粒细胞的功能,且这一功能,并不需要二肽酶活性。作者还指出,靶向I型二肽酶,具有治疗和缓解脓毒症所引起的肝肺病变的临床潜力。这篇文章的亮点有两处,一是阐明不同脏器,其募集中性粒细胞的机制也不同,这一观点还可以扩大到其他细胞类型。二是作者构建了以噬菌体库为基础的体内筛选多肽或其它化合物的方法,并成功筛选出具有生物意义和临床意义的多肽,这一方法,无论在理论研究方面,还是在药物研发方面,都具有指导意义。
原文链接:
https://doi.org/10.1016/j.cell.2019.07.017
参考文献
1. Brown, K.A., and Treacher, D.F. (2006). Neutrophils as potential therapeutic targets in sepsis. Discov. Med. 6, 118–122.
2. Rhee, C., Dantes, R., Epstein, L., Murphy, D.J., Seymour, C.W., Iwashyna, T.J., Kadri, S.S., Angus, D.C., Danner, R.L., Fiore, A.E., et al.; CDC Prevention Epicenter Program (2017). Incidence and Trends of Sepsis in US Hospitals Us- ing Clinical vs Claims Data, 2009-2014. JAMA 318, 1241–1249.
3. Genga, K.R., and Russell, J.A. (2017). Update of Sepsis in the Intensive Care Unit. J. Innate Immun. 9, 441–455.
4. Kolaczkowska, E., and Kubes, P. (2013). Neutrophil recruitment and function in health and inflammation. Nat. Rev. Immunol. 13, 159–175.
5. Ley, K., Laudanna, C., Cybulsky, M.I., and Nourshargh, S. (2007). Getting to the site of inflammation: the leukocyte adhesion cascade updated. Nat. Rev. Immunol. 7, 678–689.
6. Andonegui, G., Bonder, C.S., Green, F., Mullaly, S.C., Zbytnuik, L., Raharjo, E., and Kubes, P. (2003). Endothelium-derived Toll-like receptor-4 is the key molecule in LPS-induced neutrophil sequestration into lungs. J. Clin. Invest. 111, 1011–1020.
7. Yipp, B.G., Kim, J.H., Lima, R., Zbytnuik, L.D., Petri, B., Swanlund, N., Ho, M., Szeto, V.G., Tak, T., Koenderman, L., et al. (2017). The Lung is a Host Defense Niche for Immediate Neutrophil-Mediated Vascular Protection. Sci. Immunol. 2, eaam8929.
8. Rajotte, D., and Ruoslahti, E. (1999). Membrane dipeptidase is the receptor for a lung-targeting peptide identified by in vivo phage display. J. Biol. Chem. 274, 11593–11598.
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652475631&idx=4&sn=d8fc40f960a3c8878a4090b0bab16a21&chksm=84e2035bb3958a4d82435a2d7a9d31fb28c7e0eddc81a33ac549ae1a6dd0c43c73a801b30cc7&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn


