来源:BioArt
近数十年来,免疫治疗的发展开启了肿瘤治疗领域的重大变革,随着癌症免疫治疗领域的突出贡献者James P. Allison和Tasuku Honjo获得2018年度诺贝尔生理学或医学奖,更进一步将肿瘤免疫治疗研究推向新的热潮。肿瘤的免疫治疗主要依赖于机体T细胞介导的免疫反应。目前研究表明,肿瘤细胞死亡时释放的大量蛋白多肽碎片,将被抗原递呈细胞吞噬并由主要组织相容性复合体(MHC)呈递给T细胞,促使非活化T细胞转变为活化的T细胞。同时肿瘤细胞内突变蛋白经蛋白酶体降解形成的抗原表位由MHC呈递到肿瘤细胞表面,促使活化的T细胞通过其表面T细胞受体(TCR)对肿瘤细胞进行特异性识别以及杀伤,从而抵抗肿瘤的进展。
近年来,以CAR-T和TCR-T为基础的过继性T细胞免疫疗法(Adoptive T cell therapy)在肿瘤病人中展现的可喜的治疗效果,使得过继性T细胞免疫治疗成为肿瘤治疗领域最具前景的发展方向之一。不同于CAR-T细胞仅能靶向细胞膜蛋白,TCR-T细胞能够通过T细胞表面的TCR特异识别所有可被MHC复合体呈递的来自于胞内和细胞膜蛋白的抗原,也包括肿瘤基因突变所产生的新生抗原。因此,TCR-T具有更广泛的靶抗原库。临床试验结果表明靶向癌睾抗原NYESO-1的 TCR-T细胞疗法在治疗非小细胞肺癌、滑膜肉瘤、卵巢癌以及多发性骨髓瘤等多种癌症中已经取得了一系列令人鼓舞的成效。尽管TCR-T细胞疗法在实体瘤治疗中具有很大的应用潜力,但目前仍存在许多困难和挑战,特别是对自身抗原反应引起的脱靶毒性以及交叉反应毒性,因此临床上迫切要求我们去探寻新的肿瘤特异性抗原靶点。
2019年7月30日,中国医学科学院苏州系统医学研究所李贵登研究员以及加州理工学院诺贝尔奖奖获得者David Baltimore 在Nature Reviews Immunology上发表题为Alternative mRNA splicing in cancer immunology的综述性文章,主要探讨了mRNA加工过程中,尤其是mRNA可变剪接所产生的剪接异构体作为潜在的肿瘤免疫治疗靶点的可行性以及安全性问题,并深入分析了以选择性剪接变体为靶点的免疫治疗在临床上所面临的挑战。

一、肿瘤免疫治疗靶抗原库因选择性剪接变体而扩容
RNA可变剪接(alternative splicing)是真核细胞调控蛋白表达的一个重要机制,它使得同一基因能够编码产生多种转录本。可变剪切的形式复杂多样,主要有以下几类:外显子跳跃型(exon skipping)、内含子滞留型(intron retention)、可变5’或3’端剪切(alternative 5’ss splice or alternative 3’ss splice)、转录起始区域可变剪切(alternative TSS)以及转录终止区域可变剪切(alternative TTS)。可变剪接不但在正常细胞表达调控、生物体发育中发挥重要作用,而且与人类许多系统性疾病甚至肿瘤的发生均密切相关。在肿瘤细胞中,一些重要基因通过可变剪接产生不同于正常细胞中的剪接异构体,并直接导致了肿瘤的发生发展。
目前,直接或间接研究证据表明,肿瘤组织中相关基因的可变剪切可能会是TCR-T细胞治疗的理想的抗原靶点来源之一,其在肿瘤组织中的数量以及重要性远远超过人们的预期。首先,目前已有研究表明与正常组织相比,在肿瘤组织中存在大量的肿瘤组织特异的异常剪接异构体。这些选择性剪接产生的新抗原,也可被I型MHC复合体递呈到肿瘤细胞表面,并被T细胞所识别,这也为以选择性剪接变体为靶点的TCR-T细胞免疫治疗提供理论基础。其次,随着对基因组、转录组数据的深度挖掘以及质谱技术的发展,科研人员发现剪接异构体来源的新抗原普遍存在于大多数肿瘤病人中,并且显著高于由基因突变产生的新抗原在肿瘤病人中的普遍程度。因此,对于低突变负荷肿瘤病人来说,剪接异构体产生的新抗原则是理想的潜在治疗靶点。
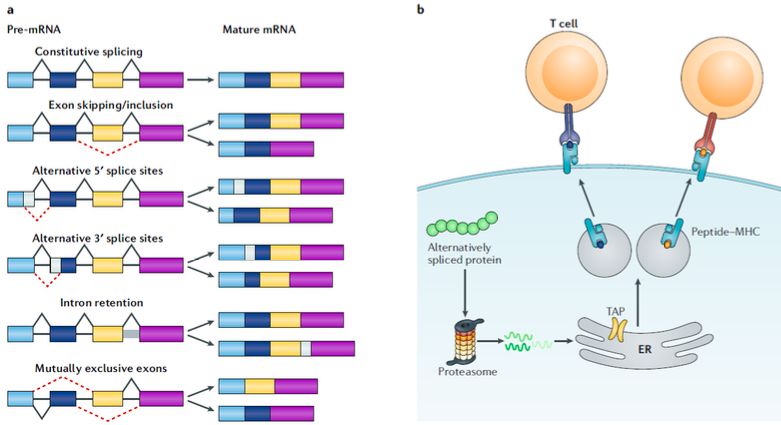
二、筛选理想的选择性剪接抗原所面临的挑战
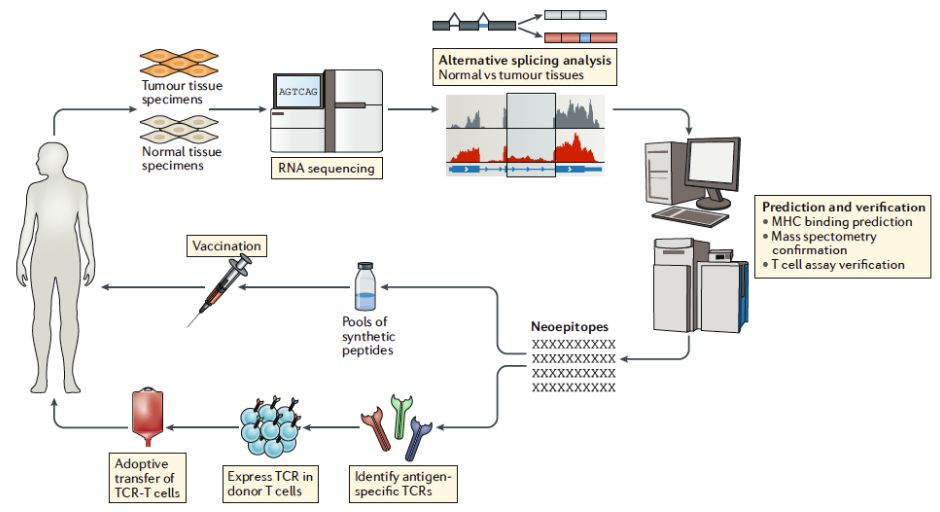
2.1 肿瘤组织特异剪接变体的鉴定
精确的筛选出肿瘤组织特异的抗原靶点对于过继性免疫治疗的治疗效果以及治疗的安全性至关重要。如何鉴定出肿瘤组织中特异的剪接变体则成为目前研究的热点和难点。由于mRNA选择性剪接方式在机体发育过程中的不同阶段以及在不同组织中均存在差异并被精确的调控,这也就要求与肿瘤组织相比对的数据需来源于多种不同正常组织或器官。在技术上,目前剪接变体的分析主要依赖于Bulk RNA-seq获得的转录本数据,然而由于肿瘤组织的特异性,使得筛选出的新的可变剪切有可能仅存在于部分肿瘤细胞中,而单细胞测序技术的兴起,使得筛选出肿瘤细胞中普遍存在的一种或几种剪接变体成为可能。但是目前单细胞测序技术体量低、高噪音的缺点,还需要结合其他技术手段,例如文库建立、新的测序方法的发展以及依赖于人工智能的机器深度学习技术,以便于高效准确的分离鉴定出肿瘤组织特异的剪接变体。
2.2 剪切变体抗原肽在细胞膜表面递呈的预测和验证
通过转录组数据分析可以获得大量的肿瘤组织特异的可变剪切事件,可是并非所有的剪接事件都被翻译成蛋白质,这就需要依赖蛋白质谱技术进一步分析确定肿瘤组织中存在的剪切异构体。即便对于已知的可被翻译成蛋白质的可变剪切,也并不能保证其一定可以被MHC复合体递呈到细胞表面。蛋白质谱技术还可用来直接鉴定被MHC复合体递呈的抗原多肽,不过这需要提供大量的临床组织样品。由于质谱技术分辨率较低,仅仅通过质谱技术难以分析出来低丰度的剪接变体来源的抗原肽,这就需要结合机器学习算法进行预测。随着人工智能领域的发展,通过机器学习,利用现有的MHC复合体多肽结合的序列信息,预测可被MHC复合体递呈的可变剪切抗原肽成为可能。由于机器算法预测的精确程度更依赖于机器训练集的质量,因此需提供大量的MHC复合体多肽信息。利用质谱技术获得的大量的被MHC复合体递呈的抗原肽信息,可以进一步应用到机器训练集中,使得机器训练集能更好地反映内源性抗原的处理过程,以便提高机器学习对剪切变体来源的抗原肽的预测精确度。
2.3 可变剪切产生的新生抗原的特异性以及交叉反应性
对于过继性免疫治疗来说,抗原的肿瘤特异性以及T细胞受体(TCR)的交叉反应性是影响临床安全的最主要的两个因素。靶抗原在正常组织中表达所引起的脱靶毒性,已在多个包括靶向MAGE-A3、MART-1、癌胚抗原以及gp100的TCR- T细胞免疫治疗中报道。由于靶向不同肿瘤组织中特异的共有抗原所面临的挑战,因此以选择性剪接新抗原为靶点的个性化免疫治疗的安全性以及临床治疗效果可能更具有优势。但是在机体发育过程中,选择性剪接事件处于动态的变化过程,这就使得筛选出的新抗原有可能在某些正常组织中低水平存在。因此在筛选肿瘤特异的可变剪切新抗原时需要有足够量以及种类的正常对照组织,以筛选出仅在肿瘤组织中表达或富集的靶抗原。由于TCR与抗原之间的识别并非是一一对应关系,一个TCR可能可以识别一系列具有相似氨基酸序列表位的抗原肽,这就是TCR的交叉反应性。目前已开发出的多种TCR靶抗原筛选平台与技术,例如基于胞啃以及液滴微流控技术的靶抗原筛选平台、酵母表面展示技术、DNA条形码多聚体技术等,都可以用于探究抗原的交叉反应性从而鉴别出与靶抗原有交叉反应性的抗原的序列信息。
2.4 可变剪切产生的新生抗原的免疫原性
研究发现可被MHC呈递展示的抗原仅有小部分具有免疫原性,可以激活T细胞的细胞杀伤毒性。影响抗原免疫原性的主要因素有抗原的丰度,抗原的加工效率,抗原肽与MHC复合体之间的亲和力、结合的稳定性以及抗原肽与其他序列相似多肽之间的竞争结合强弱等。目前已有研究表明可变剪切产生的抗原肽在体内具有免疫原性,但是由于某些剪切变体在机体发育早期表达,使得部分筛选出的剪切变体在体内的免疫原性较低。另一方面,大部分可变剪切变体表达丰度较低,这也降低了靶抗原的免疫原性。目前通常利用pMHC复合体的稳定性来间接反映抗原的免疫原性,但是这种方法很难达到较高的准确性和有效性。所以更需要利用体外实验直接检测T细胞对抗原的反应性,或者应用表达人类HLA的转基因小鼠模型快速鉴定具有免疫原性的可变剪切产生的新抗原。
2.5 肿瘤异质性和进化对靶向可变剪切抗原的免疫治疗的影响
尽管免疫治疗可在病人体内长期应答,但是肿瘤细胞的免疫逃逸能力决定了免疫治疗的临床效果。由于肿瘤细胞具有异质性,一部分肿瘤细胞不具有可被T细胞特异性识别的抗原,无法被传统的CAR-T细胞识别并清除,从而导致肿瘤免疫治疗的逃逸。靶向可变剪切抗原的TCR-T治疗同样也面临着相同的挑战。确实目前已经发现某些肿瘤特异的可变剪切靶抗原(比如EGFR的可变剪切体)只存在于部分肿瘤细胞中。更高测序深度的下一代单细胞测序技术的发展将有望于更深入的从单细胞水平了解可变剪切,并助力于鉴定广泛表达的可变剪切靶抗原。肿瘤演化是另一个影响免疫治疗效果的重要因素。在肿瘤发展过程中,可变剪切靶抗原在肿瘤细胞中的丢失以及MHC复合体表达缺失引起的靶抗原在细胞膜上的展示水平的降低,均会影响免疫治疗的效果。因此通过研究肿瘤免疫逃逸的机制和方式,开发出预防肿瘤细胞抗原逃逸或者恢复肿瘤抗原展示的新技术对提高免疫治疗患者的耐久反应性具有重要意义。
结 语
可变剪接变体来源的新抗原极大的扩充了肿瘤特异性靶抗原库,尽管其筛选和鉴定以及临床应用还面临多种挑战,但是筛选出肿瘤组织特异、高免疫原性的新抗原作为细胞免疫治疗的潜在靶点,会使更多的肿瘤病人受益。
李贵登研究员简介
李贵登,于2012年在加州大学尔湾分校 (University of California, Irvine)获得博士学位,之后加入诺贝尔奖获得者David Baltimore在加州理工学院(California Institute of Technology)的实验室进行博士后研究。现已全职加入中国医学科学院苏州系统医学研究所。李贵登研究员长期从事免疫及肿瘤的转化医学研究,在Nature Methods (一作兼共同通讯作者,2019), Nature Reviews Immunology(最后通讯作者,2019),Trends in Immunology(最后通讯作者,2019;第一作者,2013), Blood(一作兼共同通讯作者,2018),Lab on a Chip(共同一作,2018),Cell Reports(第一作者,2013)等国际学术一流期刊发表论文及综述多篇,并拥有一项国际专利。李贵登课题组将继续致力于肿瘤微环境免疫调控,T细胞受体和T细胞免疫治疗相关研究。目前该课题组正在招聘副研究员/助理研究员、博士后和科研助理。希望有兴趣的同学加盟。
原文链接:
https://www.nature.com/articles/s41577-019-0195-7
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652475199&idx=3&sn=d243f9483c2fc7377257c9aae9eba7f7&chksm=84e21c8bb395959dc9d47b2b7b3207ad158928582aa6e60d88880a24085557e52376208213c0&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



