来源:BioArt
MLL(Mixed Lineage Leukemia)复合物是调控基因转录激活的关键表观遗传因子,参与造血系统发育、成脂分化、个体发育等重要生理过程。其基因突变与白血病、Kabuki综合症、自闭症及多种实体肿瘤的病理机制密切相关。
MLL家族蛋白主要催化H3K4的甲基化,其对应的在酵母中被称为COMPASS复合物,酵母中只有一个催化亚基SET1,然而在哺乳动物中有有六个同源蛋白—SET1A、SET1B、MLL1、MLL2、MLL3和MLL4。这六个蛋白也通常以复合物的形式存在,共有的保守组分包括WDR5、ASH2L、RBBP5、DPY30,其中ASH2L和RBBP5对于MLL蛋白活性维持至关重要。
围绕组蛋白H3K4甲基转移酶复合物活性调控的结构基础和分子机制,一直是表观遗传领域的研究热点,国际上众多实验室都投入到相关研究之中。尽管过去几年有一些研究成果,但是基于MLL复合物的结构生物学基础研究才干刚开始有一些突破。
2016年上海生化细胞所雷鸣(目前任上海交通大学医学院第九人民医院精准医学研究院执行院长)、陈勇和大连化物所李国辉研究组联合在Nature上发文解析了MLL家族复合物中MLL3、MLL1三元核心复合物的活性结构(包含MLL1/3, RBBP5和ASH2L)【1】。2018年8月9日,Cell杂志背靠背在线了两篇分别来自美国华盛顿大学郑宁课题组、斯坦福大学Georgios Skiniotis与西北大学Ali Shilatifard课题组(论文第一作者为屈前辉博士)的研究长文,报道了酵母COMPASS组蛋白甲基转移酶核心催化结构域 3.0 Å的晶体结构和4.0-4.4 Å的冷冻电镜结构,为理解H3K4甲基转移酶家族的多方面功能和分子机制调节提供了重要参考意义【2,3】。然而,MLL/COMPASS复合物如何与核小体相互作用,以及H2BK120位泛素化如何调控MLL对核小体的组蛋白修饰酶活性的机制仍然不清楚。
2019年9月4日,上海交通大学医学院第九人民医院精准医学研究院黄晶课题组(薛瀚博士研究生和姚曈晖博士为文章的共同第一作者)在Nature杂志上发表了的最新研究成果Structural basis of nucleosome recognition and modification by MLL methyltransferases,首次揭示了染色质的核小体结构对组蛋白修饰酶MLL复合物的酶活调控及其分子机制,阐明了组蛋白H2B第120位赖氨酸(H2BK120)的单泛素化修饰对MLL甲基化活性的串扰调控机制(histone crosstalk),并发现了MLL复合物关键组分WDR5蛋白对MLL家族成员活性调控的迥异的分子机理及底物特异性调控机制。

该研究工作通过冷冻电镜单颗粒重构技术分别解析了人源MLL1复合物和MLL3复合物与泛素化修饰核小体及未修饰核小体的近原子分辨率结构,着重探索了MLL复合物在底物为核小体时的组蛋白修饰机制,以及MLL 家族成员底物特异性的分子机理(下图)。
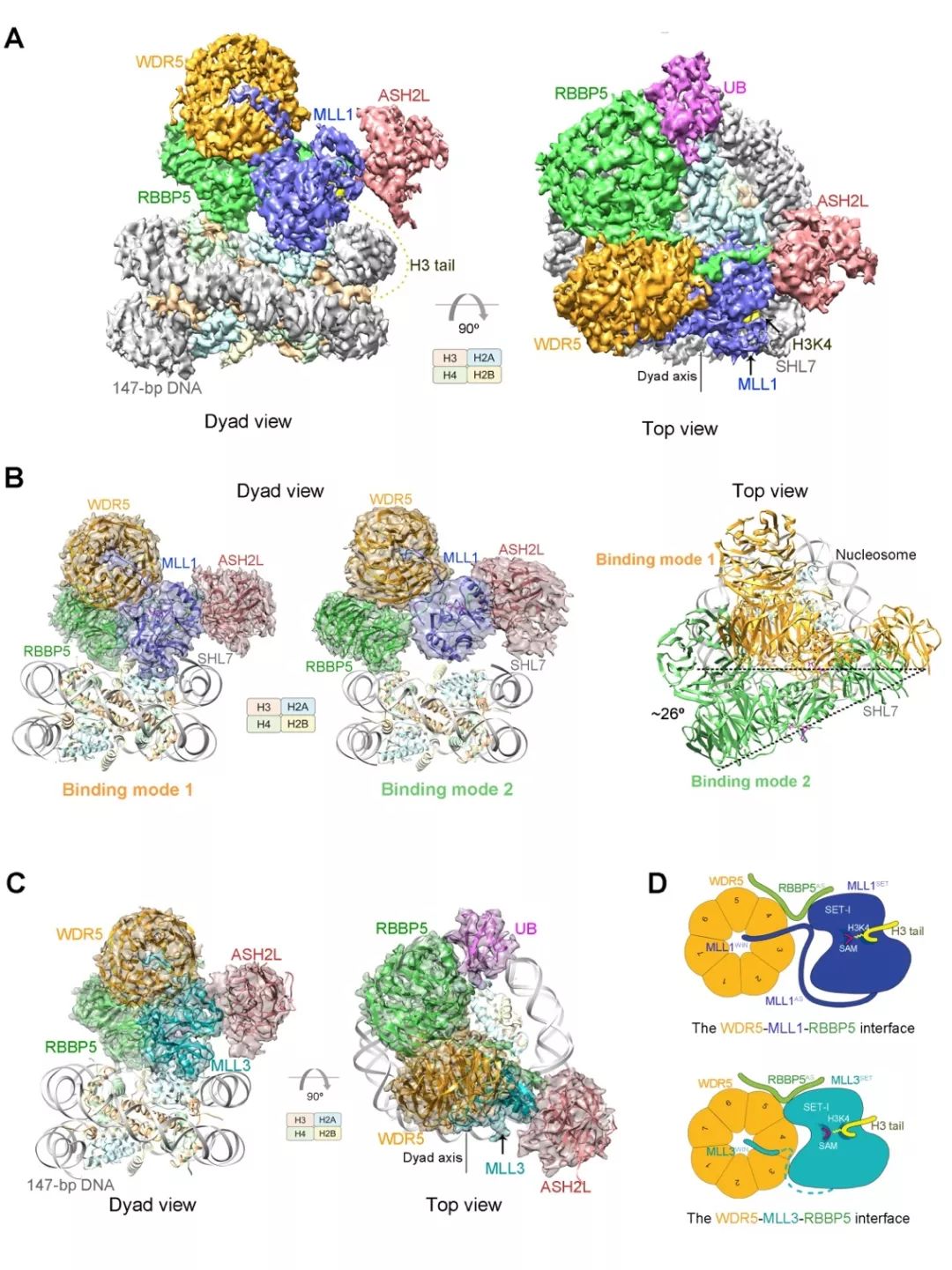
人源MLL1复合物和MLL3复合物与泛素化修饰核小体(ubNCP)及未修饰核小体(NCP)的冷冻电镜结构。(A)人源MLL1-ubNCP 复合物的冷冻电镜结构密度图。(B)人源MLL1复合物在未修饰的核小体表面呈现两种不同的结合模式。(C)人源MLL3-ubNCP 复合物的电镜结构密度图和结构模型。(D)调控MLL1和MLL3复合物的底物特异性的结构机制模式图。
组蛋白修饰通常发生在延伸于核小体结构之外的组蛋白尾端(histone tail)。以往研究认为,MLL复合物主要是通过对组蛋白H3尾端序列的特异性识别来进行组蛋白H3K4位点的甲基化修饰。而该工作表明,MLL复合物与染色质的核小体结构之间存在多个位点的特异性相互作用,促使MLL催化结构域的底物结合口袋在空间上接近组蛋白H3尾端区域,极大地提高了MLL复合物对核小体底物的催化效率。MLL复合物与核小体的特异性识别,也促使MLL的组蛋白修饰酶活性可以受到核小体上已有的其它翻译后修饰类型及其结合蛋白的调控。
最新的这项工作表明,组蛋白H2BK120位点的单泛素化修饰可通过与MLL复合物的直接相互作用,促进MLL复合物在核小体表面的定向结合,从而增强MLL对核小体的组蛋白修饰酶活性。此外,该工作还进一步发现,负责在基因启动子区域添加H3K4位点二甲基和三甲基化标记的MLL1蛋白中存在的AS(activation segment)结构域对MLL1复合物发挥高效的催化活性起到十分重要的调控作用;并且,AS结构域的构象是由WDR5所介导的多蛋白相互作用所维持的。然而,在负责执行基因增强子区域H3K4位点单甲基化修饰的MLL3复合物中,由于MLL3蛋白缺少AS结构域,导致WDR5-MLL3-RBBP5三元复合物相互作用模式发生了改变,致使WDR5与MLL3的催化结构域直接结合,抑制了MLL3的组蛋白转移酶活性。
总的来说,该工作在染色质核小体水平上揭示MLL复合物催化组蛋白H3第4位赖氨酸(H3K4)甲基化修饰的分子机制,也为MLL复合物的靶向药物开发提供了新的研究思路。
另外,特别值得一提的是,相关领域的研究竞争非常激烈,就在这篇文章在线前不久(8月16-20日),两个课题组将相关的研究工作发布在bioRxiv上(下图),其中一个是酵母COMPASS复合物与核小体的冷冻电镜结构,另一个是人源MLL复合物与核小体的冷冻电镜结构。


2018年Cell论文【2】的第一作者屈前辉博士评论认为,“这些研究工作首次揭示了COMPASS/MLL作用于底物核小体的分子机制,展现了H2B泛素化修饰影响H3K4甲基化的结构基础。之前报道的WDR5蛋白能识别H3K4不同甲基化程度的小肽,尽管在这些复合物结构中并未发现WDR5直接结合底物核小体,并不能排除其可能在染色质高级构造中发挥作用。此外,对各类MLL发挥的不同生理作用的理解有待于进一步的研究。”
最后,不得不说冷冻电镜确实是非常强大,近期围绕表观遗传合体调控复合物的系列完整结构(表观因子加核小体)为深入阐明表观修饰的核心调控机理奠定了坚实的基础。前不久,就有五个课题组(其中之一是本文的通讯作者黄晶团队完成,发表在Cell Research)差不多在同一时期对H2BK120单泛素化调控Dot1L修饰H3K79甲基化的结构功能进行了研究,共同揭示出了H2BK120单泛素化与H3K79甲基化之间crosstalk的机制细节(详见此前BioArt的报道:聚焦丨五个不同研究组共同揭示组蛋白H2BK120泛素化调控甲基转移酶Dot1L修饰H3K79的分子机制)。相信,用不了多久,其它一些关键的表观修饰复合物与核小体的冷冻电镜复合物结构也会慢慢出来。事实上,借用强大的冷冻电镜,后期甚至还可以做更高级别的复合物,例如基于表观修饰复合物与30nm染色质相互作用的结构。
原文链接:
https://www.nature.com/articles/s41586-019-1528-1
参考文献
1、Li, Y., J. Han, et al. (2016). "Structural basis for activity regulation of MLL family methyltransferases."Nature 530(7591): 447-452.
2、Qu, Q. et al. Structure and conformational dynamics of a COMPASS histone H3K4 methyltransferase complex. Cell 174, 1117–1126.e12 (2018).
3、Hsu, P. L. et al. Crystal structure of the COMPASS H3K4 methyltransferase catalytic module. Cell 174, 1106–1116.e9 (2018).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652474833&idx=2&sn=3e0344a27a22a9adc5650f61c1b9637c&chksm=84e21e65b395977317bd011afe167c421ee9be1860b49ae6abd74958952009742b85ec15d944&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



