来源:药学进展
专家介绍:沈子龙

教授,博士生导师。1965年毕业于中国科学技术大学近代化学系,并进入中国原子能科学研究院同位素研究所工作,从事放射性药物的研制。1980年被引进入中国药科大学,先后在药理研究室和生物技术研究中心从事教学和研究工作。曾担任中国药科大学生物技术研究中心和同位素研究室主任,创建了中国药科大学同位素实验室,为放射性同位素在药学中应用创建了新平台。主持过多项国家、省部级研究项目,发表科研论文近百篇,获国家发明专利8项。作为高级访问学者,于1992年赴日本岐阜药科大学进行合作研究。在国内首先用转基因山羊乳腺反应器制备出了溶血栓药物-组织纤溶酶激活剂(r-PA),并先后用放射性同位素标记示踪法对干扰素α-2a、α-2b脂质体、PEG修饰α-2b、蛇毒纤溶酶等50多种“蛋白、多肽和小肽类药物”的药物代谢动力学进行了研究,为新药研发提供合格的药物代谢动力学报批资料;还对雷公藤巴布剂、黑膏药、雌二醇等特殊制剂进行药物透皮吸收动力学研究,为上述新药研究开发作出了贡献。
专家介绍:徐寒梅

中国药科大学教授,博士生导师,江苏省合成多肽药物发现与评价工程研究中心主任,国家药典委员会委员,中组部“万人计划”入选者。多年从事多肽药物的研究,带领团队自主设计合成了多个多肽药物、转让了4个1类多肽新药,有2个已经进入临床研究。近5年在国内外发表学术论文80余篇,SCI论文35篇;主编及参编论著各1部,主编教材1部;申请发明专利及软件著作权共35项(其中国际专利5项),获得授权15项。近年来,先后带领团队主持了:国家自然科学基金,国家“863”高科技发展计划,国家“十一五”、“十二五”、“十三五”重大新药创制科技重大专项多项,江苏省校企合作前瞻性研究等项目。2014年获得江苏省医药科技奖一等奖(排名第一),曾获得科技部创新创业人才、南京市领军人才、科技创业家等称号。
正文
同位素示踪技术在药学研究领域的应用进展
[摘要]同位素示踪技术具有灵敏度高、适用范围广、检测方便等特点,是医药研发领域中重要的研究手段。同位素示踪技术有望在探索疾病的发生、发展和转归以及药物评价中发挥桥梁作用。对近年来同位素示踪技术应用于疾病机制探索及药学研究的新进展进行综述。
同位素示踪技术是利用稳定性或放射性同位素标记的化合物研究物体运动过程及其规律的一种研究方法,其在新药研究的药动学特性探索中扮演着不可代替的角色。近年来,同位素示踪技术具有测定过程稳定、样品检测限较低和前处理过程方便等优点,逐渐拓展到药物研发的各个方面。随着单光子发射计算机断层显像(SPECT)和正电子发射计算机断层显像(PET)的不断发展,以及新型特异性示踪剂的开发及应用,同位素示踪技术取得了飞跃性的发展,其对疾病机制研究及临床诊断也显示出重要的推动作用。本文对同位素示踪技术在疾病机制探索及药学研究中的新进展进行综述。
1同位素示踪技术在疾病机制探索中的应用
1.1细胞凋亡研究
细胞凋亡是机体通过特定机制调控产生的细胞自发、程序性的死亡,它发生于胚胎发育、免疫防御等阶段,具有广泛的生物学意义。凋亡异常可诱发多种疾病,如自身免疫性疾病、癌症等。多种癌症的治疗都是通过诱导肿瘤细胞的凋亡途径(如Caspase-3、Bcl-2/xL、IAPs、MDM2-p53等凋亡通路)实现的。采用同位素示踪技术对细胞进行实时、无创的观察有助于研究疾病发生发展的机制。放射性同位素标记的细胞凋亡显像剂可与凋亡细胞特异性结合,应用于凋亡的早期检测而不受探测深度制约。在凋亡早期,细胞内会出现膜小叶和细胞内液酸化,采用18F标记2-(5-氟代戊基)-2-甲基丙二酸(ML-10),细胞凋亡时,该探针的丙二酸模体核心中的2个羧基俘获质子,使负离子分散在环状结构中,增加疏水性。已被酸化的探针进而通过疏水的羟基到达胞质,结合带负离子的蛋白质,从而富集于胞质。18F-ML-10已进入临床研究阶段,匹兹堡大学医疗中心Oborski等在已接受治疗的多形性成胶质细胞瘤患者体内注入18F-ML-10进行检测,结果显示体内的肿瘤细胞凋亡与该分子探针的摄取量变化相关。用于评估治疗前和治疗后早期肿瘤细胞凋亡的变化,是临床上评估新诊断患者的早期治疗反应的一种新方法。多种凋亡信号通路涉及Caspase-3的活化,靶向Caspase-3是凋亡显像的重要研究方向。18F-CP18包含与Caspase-3蛋白高度亲和的识别序列DEVD(Asp-Glu-Val-Asp),同时还可通过结构中的聚乙二醇链进行跨膜转运。当用细胞凋亡诱导剂处理时,体外细胞实验测定结果显示肿瘤细胞中Caspase-3依赖性摄取18F-CP18。在凋亡细胞中,活化的Caspase-3剪切PEG链使显像剂滞留在细胞内,从而显像。将18F-CP18注入非小细胞肺癌小鼠模型内,PET显像后发现术后肿瘤部位出现放射性浓影,证明该显像剂可检测癌症治疗中的早期凋亡,有希望开发成新的PET显像剂。
除小分子探针外,蛋白多肽活性物质也是同位素标记凋亡探针的重要来源。细胞凋亡早期会出现胞膜内侧磷脂酰丝氨酸(phosphatidylserine,Ps)的外翻。钙依赖性磷脂结合蛋白AnnexinV与Ps具有高度亲和力(Kd=0.1nmol·L-1)。细胞凋亡时AnnexinV在钙离子存在下与外翻的Ps结合并变构为三聚体,覆盖于膜外侧的Ps上。99Tcm标记AnnexinV已成为细胞凋亡检测的常见方法。Witney等使用配体螯合物HYNIC与AnnexinV连接,在Sn2+存在下经99Tcm标记制得99Tcm-HYNIC-AnnexinV。再将该探针注入荷淋巴瘤EL-4的模型小鼠体内,结果显示药物摄取量与肿瘤细胞的早期凋亡相关。99Tcm标记的SAAC-PSBP-6多肽与Ps高度亲和,研究发现对99Tcm-SAAC-PSBP-6SPECT显像可以检测药物治疗后肿瘤细胞的早期凋亡。
1.2DNA损伤修复研究
DNA损伤是导致基因突变及转录活性异常的重要原因。机体通过DNA损伤修复(DNAdamageresponse,DDR)机制以避免细胞对DNA损伤反应异常引发的肿瘤疾病。上述过程涉及多信号通路的胞内因子表达变化,这可以为同位素示踪技术提供理想的位点。由于DDR参与肿瘤发生发展过程,利用同位素示踪技术检测DDR有助于研究肿瘤发生发展机制,并监测DNA损伤治疗的效果。
DNA损伤有多种不同的形式,其中包括DNA单链断裂(DNAsingle-strandbreaks,SSBs)和DNA双链断裂(DNAdouble-strandbreaks,DSBs)。多聚(ADP-核糖)聚合酶-1(PARP-1)在细胞内主要参与DNA损伤修复、维持基因组完整性以及基因转录调节等,是DNA单链断裂损伤修复的关键位点。PARP-1识别并结合到DNA断裂处,激活并催化受体蛋白的聚ADP核糖基化,完成DNA修复工作。PARP-1是DNA损伤的主要生物标志物。Zhou等发现苯并咪唑类化合物NU1085的结构类似物可以显著抑制PARP-1,其中18F-FluorThanatrace(18F-FTT)具有显著的比活力(5.5×106~1.8×107Ci·mol-1),且其IC50也相对较低[(6.3±1.3)nmol·L-1],MDA-MB-231荷瘤模型(低PARP-1表达)及MDA-MB-468荷瘤模型(高PARP-1表达)等多种移植瘤模型动物注入探针后,PET/CT显像证明体内肿瘤组织对18F-FTT的富集程度与移植瘤模型PARP-1表达呈显著相关。18F-FTT探针可以通过监测体内PARP-1水平描述DNA损伤程度。
DSBs是最严重的DNA损伤形式,可能会引发癌症等相关疾病。细胞在发生DSBs时产生应激反应,导致毛细血管共济失调突变基因产生信号级联反应。组蛋白H2AX是该级联反应的重要位点,可被共济失调突变基因磷酸化形成γH2AX。γH2AX再招募其他修复因子进行损伤修复,是DSBs的重要生物标志物,可作为检测肿瘤细胞DNA损伤修复的靶点。由于γH2AX抗体的相对分子质量较大,难以直接通过胞膜结构,通常需要用细胞穿膜肽(cellpenetratingpeptides,CPPs)TAT进行修饰。Cornelissen等首次采用111In修饰anti-γH2AXTAT,并将该探针注入MDA-MB-468乳腺癌移植瘤模型小鼠。SPECT结果显示,肿瘤对111In-anti-γH2AX-TAT的吸收值与DNA损伤程度显著相关。这表明该核素探针可以无创性地观察肿瘤DNA损伤过程。MDA-MB-468乳腺癌移植瘤小鼠的肿瘤组织在辐射(10Gy)下对89Zr-anti-γH2AX-TAT的吸收较对照组(0Gy)明显更多。2同位素示踪技术在药学研究中的应用2.1药物治疗靶点研究基于细胞或动物模型的靶向候选药物的发现和筛选中,只有找到合适的靶点分子才能更好理解疾病发生发展的分子机制,研究药物与靶点结构互相作用的本质,从而更加有针对性地设计和改造化合物,增加药物研发的可预测性和成功率。目前已知的药物靶点98%以上属于蛋白质,包括G蛋白偶联受体、酪氨酸蛋白激酶及磷酸二酯酶等。目前,尽管以RNA干扰(RNAinterference,RNAi)为代表的遗传学手段在药物靶点的鉴定方面有成功的案例,但通过蛋白质芯片、同位素标记的策略以及化学蛋白质组学等技术发现及鉴定药物靶点才是更加直接有效的方法。其中,同位素示踪技术作为工具应用于靶点的发现是当前药物研究的重要手段。ⅠA和ⅠB期的非小细胞肺癌患者接受治疗后5年存活率分别为83%和71%,而Ⅱ期患者的存活率仅有50%,这说明中期肺癌的治疗模式仍有较大提升空间。目前,手术治疗和辅助化疗仍然是治疗早期肺癌患者的常用方法,在晚期肺癌治疗中效果显著的免疫检查点抑制剂(如PD-1及PD-L1抗体)并未被用来治疗早期肺癌患者,其主要原因是早期肺癌组织的肿瘤微环境免疫状况尚不清楚。Lavin等收集了28名早期及晚期肺腺癌患者的肿瘤样本、正常肺组织及血液,并在细胞水平上分析样品,绘制肿瘤细胞免疫组分图谱。研究人员设计出一种“条形码系统”,其可以对样本中的所有细胞类型采用不同同位素标记示踪。然后运用飞行时间质谱流式细胞术(masscytometrybytimeof-flight,CyTOF)与单细胞转录组学(single-celltranscriptomics)和肺部肿瘤的多重成像技术相结合,在单细胞水平对肿瘤细胞的免疫状况进行同时分析。结果显示在早期肺腺癌组织周围就聚集着大量抑制性巨噬细胞和T细胞,同时表现出NF-κB诱导激酶(NF-κB-inducingkinase,NIK)细胞的损耗,这表明免疫细胞在肿瘤形成早期就产生功能失调。同时,还发现免疫检查点蛋白PD-1和PD-L1也已经分别出现在部分CD4+和CD8+的T淋巴细胞和巨噬细胞表面,因此,在肿瘤疾病早期使用免疫疗法有望为临床治疗带来新的希望。
早老症(Hutchinson-gilfordprogeriasyndrome,HGPS)是一种罕见的遗传疾病,患者的衰老速度是正常人的8~10倍且往往过早死亡。早老症的分子致病机制被认为是细胞核中核纤层蛋白A(laminA)的LMNA基因位点突变引起的蛋白改变,但该单一核蛋白突变引起机体急剧老化的具体机制尚未清楚。为证实突变是否通过改变laminA结构使其失活,从而诱发衰老,使用稳定同位素标记氨基酸培养细胞技术(stableisotopelabelingbyaminoacidsincellculture,SILAC)标记早衰患者和健康人的成纤维细胞蛋白组,由此监测成纤维细胞的蛋白质周转情况。质谱结果显示,正常细胞的laminA在6d内就显著发生周转,而laminB较为稳定。但HGPS患者细胞lamins蛋白家族均产生显著的蛋白质周转加快。进一步研究细胞核仁蛋白质组的周转频率,证明了HGPS患者细胞的整体蛋白质组周转及代谢均发生变化。同时由于体内蛋白质组的表达水平上升,细胞中核仁的大小会随衰老而变大,这表明核仁的大小和活性可能是人体衰老检测的生物标志物,并有望成为抗衰老的靶点。腺苷酸活化蛋白激酶(AMPK)能够在体内增强肝脏和骨骼肌对于葡萄糖和脂肪的吸收,因此长期被认为是2型糖尿病及脂肪肝等代谢综合征的潜在治疗靶点。辉瑞公司使用同位素检测结合时间分辨荧光技术筛选出可以直接激动AMPK并保护AMPK中α亚基的Thr172磷酸化位点不被去磷酸化的小分子化合物。该候选化合物在ZSF-1肥胖大鼠模型中可以显著提高肾脏AMPK磷酸化水平,且明显改善模型动物的蛋白尿症状。同时,该药物在大鼠、犬及食蟹猴中的药动学研究已完成,目前正在进行人体药动学及安全性评价的临床研究。
2.2药物代谢研究
2.2.1药物体内处置放射性标记化合物是待测药物相关代谢产物在体内回收的完美工具。目前,在药物研究策略中采用放射性同位素示踪法标记研究药物在体内循环中的处置及转化过程已经成为常见方法。抗肿瘤药物zebularine属于DNA甲基转移酶抑制剂,Beumer等检测小鼠体内14C-zebularine的体内转化,其中尿液及组织的放射回收率分别占到30.3%及6.1%,还有约55%的放射活性以14CO2的形式呼吸释放。林立红等采用14C标记2-氟-6-三氟甲基吡啶药物,研究大鼠单次腹腔注射100mg·kg-1后的组织分布及代谢情况。通过液体闪烁计数分析收集的血浆、器官、胆汁、粪便及尿液的总放射性,结果显示给药后72h,药物基本从血液及组织消除,胆汁放射回收率为28.1%,给药168h后粪便、尿液及洗笼液的放射总回收率分别为43.1%、29.7%、9.97%。其中胆汁与粪便的排泄数据基本相同,表明该药物肠道吸收完全,28%的药物通过肝肠循环从粪便排泄。
整体自显影技术(wholebodyautoradiography)是将注射同位素示踪剂的动物模型制成整体组织切片进行自显影的技术。Parkash等采用14C标记研究非甾体选择性雌激素受体调节剂拉索昔芬(lasofoxifene)在大鼠体内的代谢过程。整体自显影结果显示单次注射后药物总放射回收率可达96.7%,且主要排泄途径为粪便,大鼠粪便及尿液中的放射总回收率分别为76.2%和13.6%。Parkash等还采用LC-MS/MS对22种代谢产物进行初步鉴定,推断该药物在大鼠体内主要通过吡咯烷环氧化、四氢萘芳环羟化、儿茶酚中间体甲基化等6种途径代谢。
2.2.2代谢产物分析代谢产物研究是药动学的重要内容。熟悉代谢物信息可以帮助预测药物体内的代谢途径、临床药效及可能毒性。同位素示踪技术具有测定过程稳定、检测限较低和前处理过程方便的优点,是代谢物研究的理想工具。但作为非特异性检测技术,同位素示踪技术在研究中为区分原药与代谢产物,常采用联合色谱/质谱仪器的方法,通过药物组分在色谱柱中流入检测器的不同保留时间实现分别定量,再依据药物代谢特性确证代谢产物的结构及种类,推断药物体内代谢途径,研究代谢情况。Hansen等通过固相萃取法纯化人血清样本后,以稀释的同位素内标消除LC-MS/MS中的基质效应,对11种甲状腺激素代谢物进行定性及精密定量分析。(+)-[18F]flubatine是烟碱乙酰胆碱受体的PET放射性配体。Ludwig等研究了(+)-[18F]flubatine在早期阿尔茨海默病患者体内的代谢过程,给药后收集患者尿液及粪便进行放射性同位素示踪-HPLC检测,并通过对比LC-MS/MS结果推测了(+)-[18F]flubatine主要代谢物结构。腺苷A2a受体拮抗剂tozadenant对帕金森病具有良好疗效,在临床研究中采用14C标记并给药,测得粪便及尿液的放射总回收率分别为11%及12%,并通过联用LCQTOF/MS及液体闪烁计数法研究药物代谢谱及代谢物结构,确证了16种代谢产物的结构。
离体组织或细胞常作为药物体外代谢研究平台,采用同位素标记示踪技术可直观地研究药物体外代谢情况。Wind等采用稳定性同位素氘标记哌嗪类药物BAL30630,并将其与大鼠肝原代细胞共孵育。稳定性同位素在该药物代谢过程中可交换至环氧或羟基化代谢物,通过HPLC-QTof-MS定性及定量检测出9种体外代谢产物,通过代谢物结构推断出BAL30630首先在肝原代细胞中被氧化,再发生葡糖苷酸化,被代谢成氨基甲酸酯水解产物。
2.2.3组织整体代谢同位素示踪技术还可以利用组织特性,通过同位素标记药物的体内处置研究病灶部位的整体代谢水平。肿瘤细胞亚群具有代谢旺盛的特点,其糖摄取过程较正常组织细胞明显更为旺盛。因此,可利用糖的同位素标记化合物作为显像剂对肿瘤病灶进行分子显像。Lin等采用99Tcm标记已合成的脱氧葡萄糖类似物99Tcm(CO)3-DGDTC,SPECT显像显示该探针明显富集在S180小鼠移植瘤中,且4h时肿瘤/肌肉、肿瘤/血液的放射摄取比分别为7.29及1.67。该现象同样出现在兔荷瘤模型中。肿瘤代谢体积(MTV)可以显示肿瘤病灶整体对显像剂的摄取情况,反映肿瘤负荷情况。糖酵解总量(TLG)则是结合肿瘤代谢体积与代谢水平高低(SUVmean)的半定量参数,其代表肿瘤的整体代谢情况。MTV及TLG对化疗疗效的预测价值使其成为目前研究热点。Lim等将18F-FDG注入口腔鳞癌患者体内,结果显示治疗前后MTV的差值可以预测组织病理改变,进而推断化疗疗效(P=0.005,HR=2.4),TLG的改变可以预测肿瘤远端转移及患者总体存活率(P<0.001,HR分别为1.6及1.7)。MTV及TLG对肿瘤化疗疗效预测的准确性仍需进一步确定,但由于TLG和MTV是反应机体糖代谢的指标,可以从代谢的角度评价化疗的疗效。因此,对于肿瘤治疗的早期评价,选用代谢评价方法较临床常用的PERCIST标准可能更接近真实情况。
2.3药物体内作用及机制研究
采用放射性同位素标记示踪是药物研发中体内行为研究的重要手段。对于作用机制尚不明确或需要验证的药物,可尝试通过同位素标记技术监测体内作用,并依照体内分布过程及下游蛋白表达水平确证药物作用机制,进而更好地指导药物的开发利用。腺苷(adenosine)作为多功能的内源性核苷具有显著的神经保护作用,但其在临床应用中受限于极快的体内代谢。将腺苷共价连接到角鲨烯(squalenoyl)脂质,合成了具有纳米结构的角鲨烯-腺苷(SQAd),该药物在脑缺血和脊髓损伤的临床前模型中均表现出显著的药理活性。采用SQ-[3H]-Ad及[14C]-SQAd分别作为腺苷及角鲨烯的示踪剂研究其血浆及组织分布,并结合HPLC确证了药物代谢谱。结果显示,相比于未修饰腺苷,SQAd在静脉注射后显著分布于小鼠肝脏及脾脏,并可向血液循环持续释放腺苷长达1h,显著改善腺苷与神经血管内皮细胞的相互作用。SQAd的代谢途径很好地解释了其用于脑缺血和脊髓损伤的治疗效果。
陈红谨等采用115I及116I标记中药益糖康治疗后的糖尿病大鼠样品蛋白,并采用超高效液相色谱-四级杆/静电场轨道阱高分辨质谱(UHPLC-Qexactive)进行分离分析,得到给药组与空白组的蛋白差异表达谱。由此推断出中药益糖康可通过修复体内蛋白合成过程来降低血糖,改善机体糖脂代谢,从而达到治疗糖尿病的药效。放射性同位素标记的相对及绝对定量技术(iTRAQ)是适用于蛋白多肽药物定量的多样本体外标记新技术。霍亚妮等采用iTRAQ研究金雀异黄酮作用后的肝纤维化大鼠模型的肝部蛋白表达,通过筛选585个蛋白的表达水平发现,金雀异黄酮可通过调节肝组织中CYP4A2、Apoa1等关键蛋白达到抑制肝纤维化的效果。iTRAQ由于其多样本精准定量的特点,还可以作为蛋白质相互作用、药物作用靶点及通路研究的重要工具,并为药物体内作用机制研究提供依据。
贝伐单抗(bevacizumab)是靶向血管内皮生长因子(VEGF)的单克隆抗体,Desar等在VEGF靶向药物索拉菲尼(sorafenib)的临床研究中同时采用111In标记的贝伐珠单抗,结果显示随着药物的治疗,肿瘤组织对贝伐珠单抗的摄取量显著减小。Desar等认为111In标记的贝伐单抗可作为靶向药物的靶向分子显像剂,用于监测药物的体内作用。Heskamp等同样发现贝伐单抗治疗会使肿瘤组织对111In标记西妥昔单抗(cetuximab)的吸收降低约40%。但靶向治疗会改变靶点分子表达,可能会影响肿瘤部位的同位素标记药物的摄入,因此该理论仍需进一步证明。如Terry等发现靶向αvβ3的贝伐单抗并没有改变肿瘤组织对相同靶点的同位素标记RGD序列多肽的摄入量。
3放射性药物在疾病诊断和治疗中的应用
利用以同位素示踪为基础的放射性药物为探针,靶向机体内各生物分子,并结合SPECT或PET进行生物分子功能显像已广泛用于研究体内靶分子的生理及病理等基本过程。同时,在分子水平研究疾病的形成过程中,同位素示踪技术可以为疾病的早期诊断、治疗以及相关药物的筛选提供精确的信息。因此,具有临床应用前景的放射性药物可以将疾病诊断及治疗提升至细胞、分子水平,具有极高开发前景。
3.1肿瘤疾病
有效检测肿瘤生物标志物可以很大程度上提升靶向治疗的临床应用,但肿瘤针吸及术后的免疫组化分析显然无法获得未切除组织及远处转移灶的表达情况,而诊断用放射性药物可以实现精准且无创的生物标志物检测,为制定恶性肿瘤的治疗方案提供关键信息。人表皮生长因子受体2(humanepidermalgrowthfactorreceptor2,HER2)是一种高表达于多种肿瘤细胞的生物标志物,在肿瘤的发生、发展过程中起重要作用。同时HER2也是肿瘤靶向治疗的主要目标受体,已有多种靶向HER2的药物获批准上市,如曲妥珠单抗(trastuzumab)和小分子抑制剂厄洛替尼(erlotini)等。Ulaner等采用双功能螯合剂p-SCN-Bn-deferoxamine(DFO)对帕妥珠单抗(pertuzumab)进行89Zr标记,构成分子探针89Zr-DFO-pertuzumab,PET/CT显示该分子探针可以进行乳腺癌患者体内的多组织器官成像,并成功预测了患者的HER2的高表达,有望成为临床诊断的有效手段。此外,已报道用作放射性药物的HER2特异性靶向剂还包括免疫球蛋白片段F(ab’)2、纳米抗体及亲合体等。预设计锚蛋白重复蛋白(designedankyrinrepeatproteins,DARPins)可作为HER2的特异性靶向剂。DARPins属于演变自天然锚蛋白重复序列的新型结合蛋白,其可通过锚定重复单元的序列位点进而实现与靶受体的高亲和力结合。DARPins的高渗透性、高亲和力及强稳定性等特性克服了传统抗体类靶向剂的缺点。DARPins蛋白G3可与谷氨酰组氨酸(HE)3结合并形成(HE)3-G3,采用111In及125I标记(HE)3-G3,然后给荷瘤模型小鼠注射显像剂,4h后,标记药物均可在HER2的阳性病灶处显像,且111In-(HE)3-G3在肿瘤组织具有较高的分布体积与血清清除速率,24h时肿瘤/血液放射性比值高达343.7±161.3,可形成清晰的分子影像。
CD30是由TNFRSF8基因编码的肿瘤坏死因子受体超家族蛋白。研究表明CD30在霍奇金淋巴瘤及间变性大细胞淋巴瘤中高表达,且存在较差的预后效果。Rylova等采用螯合剂去铁胺(deferoxamine,DFO)连接89Zr及CD30鼠源抗体AC-10,并注射入荷有淋巴瘤Karpas299的小鼠(CD30阳性模型)及荷有上皮细胞瘤A-431的小鼠(CD30阴性模型)体内,PET/CT结果显示72h后,89Zr-DFO-AC-10在CD30阳性小鼠模型中富集于肿瘤组织,CD30阳性肿瘤中89Zr-DFO-AC-10的摄取量为(37.9%±8.2%)IA·g-1,而CD30阴性肿瘤的摄取量为(11.0%±0.4%)IA·g-1。肿瘤/血液放射性比值为5.95±1.36,肿瘤/肌肉放射性比值为77.24±22.9,而荷上皮细胞瘤A-431小鼠的肿瘤组织中分子探针仅占总量的11.0%±0.4%。因此,89Zr-DFO-AC-10可在体内富集于高表达CD30的淋巴瘤组织,并具有良好的显像性。细胞表面糖蛋白CD44的V6剪接体与肿瘤疾病发生、肿瘤细胞的侵袭及迁移有密切关系,其在鳞状细胞癌上多高表达。有研究表明,标记89Zr的抗CD44V6嵌合单体89ZrcU36能够检测头颈鳞癌移植瘤。此外,CD20、VEGF及前列腺特异性膜抗原(PSMA)等生物标志物用于临床医学中肿瘤疾病的检测也常有报道。
CD13也称氨肽酶N(aminopeptidaseN,APN),是依赖锌离子的膜外肽酶,含有NGR(天冬酰胺-精氨酸-甘氨酸)序列的肽通过与CD13特异性结合能用于肿瘤血管靶向显像和治疗。靶向显像在靶向治疗前进行,则能够了解肿瘤表达CD13的情况,从而预测及监测肿瘤靶向治疗的可行性,做到有的放矢。用正电子放射性核素68Ga或64Cu标记NGR单体或二聚体,对CD13受体表达阳性的肿瘤进行PET显像研究发现,NGR单体及二聚体均可靶向聚集于肿瘤组织,并且二聚体表现出更高的肿瘤摄取。虽然放射性核素64Cu标记的多肽在体内展示了很好的CD13特异性,肿瘤的放射性摄取增高,但同时对非特异性组织如肝脏有较高的放射性积聚,可能是由于与64Cu螯合物在体内不够稳定,有一定数量的脱甲基(脱标),导致64Cu在小鼠肝组织聚集,而68Ga标记的化合物从肾脏排泄,在其他非靶组织的摄取可以忽略不计。
3.2心血管疾病
心血管疾病是如今世界上发病率及死亡率最高的疾病之一。依靠传统方法在人体内识别引起心脏病发作的动脉粥样硬化(atherosclerosis,AS)难以实现。放射性药物的发展为检测具有临床意义的动脉粥样硬化提供了新的思路。动脉粥样硬化斑块形成过程伴随着单核细胞及巨噬细胞数目的显著增长,研究人员采用89Zr标记葡聚糖纳米颗粒(dextrannanoparticle,DNP),结果显示89Zr-DNP在载脂蛋白E敲除小鼠(动脉粥样硬化易损斑块模型)中的主动脉摄取量显著高于野生型小鼠。Ishino等建立兔动脉粥样硬化模型,进行了单抗99Tcm-凝集素样氧化低密度脂蛋白受体-1(LOX-1)-mAb的实验评价,分别于给药10min和24h后显像,结果显示10min时血液中放射性摄取明显,24h后放射性基本清除,模型组动物主动脉处放射性摄取明显,对照组动物主动脉处无放射性摄取。显像结束后处死动物,模型组主动脉放射性摄取为对照组的10倍。放射性自显影和组织切片检查结果表明,放射性摄取与LOX-1表达的相关性显著(r=0.64,P<0.0001)。动脉粥样硬化病变过程中,趋化因子CCR5表达显著上调。有报道采用64Cu连接DAPTA肽(可靶向CCR5),该探针在体内有效富集于损伤血管,可作为动脉粥样硬化无创化评估的有效手段。
3.3神经系统疾病
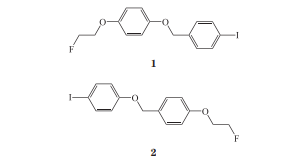
β样淀粉蛋白(amyloid-betaprotein,Aβ)在人体内可促进引发阿尔茨海默病,通过分子对接及三维定量构效关系(3D-QSAR)模型指导合成可被125I及18F标记的多种苯基苄基醚类似物。其中配体1及配体2均表现出良好的Aβ亲和力。同时,在体内分布实验中,125I及18F标记的配体1和配体2具有较高的脑摄取。PET及SPECT成像显示模型小鼠的脑组织中能显著观察到放射性,且125I-配体1对Aβ斑块具有很强的标记能力,该分子探针有望作为PET及SPECT中的显像剂对Aβ斑块进行识别。葡萄糖代谢显像剂18-氟-2-脱氧-D-葡萄糖(18F-FDG)为脱氧葡萄糖类似物,是目前PET/CT检查中应用最广泛的非特异性正电子放射性药物,主要用于肿瘤、脑、心血管等方面疾病的诊断,可作为诊断帕金森病不同临床阶段变化的放射性显像剂,对于帕金森病的鉴别诊断以及病理过程、治疗效果的评估有一定应用价值。此外,具有无创性、实时监测的放射性核素显像剂还被报道用于描述脑卒中过程中的细胞死亡以及评估脑组织损伤区域等。
4结语
同位素示踪技术是药物开发及代谢物研究中不可或缺的手段。近年来,随着技术的不断进步及SPECT等检测仪器的开发及推广,同位素示踪技术的应用范围拓展到药学研究的各个方面,同时也为疾病机制研究提供有力支持。当前,PET/CT、SPECT/CT和PET/MRI等新型融合成像技术既可进行功能成像,又可进行结构定位,能够准确显示机体的生理代谢情况和解剖结构,是同位素示踪技术进一步应用于药学研究的发展方向。
来源:ppsyxjz 药学进展
原文链接:http://mp.weixin.qq.com/s?__biz=MzA5MDY3ODExNQ==&mid=2651306739&idx=1&sn=5cd21e5e8218c79333f2d05dee36f94d&chksm=8bf4ecffbc8365e906476a7751a6cc26d71519c44afea8c78e3450f694d35c680709c44d6e62&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn


