来源:BioArt
二十一世纪的今天,生命科学研究的相关技术已经发展到了一个相当高的层次。生命个体的各种细微的变化都能被人类“见微知著”,通过不同的技术手段转化成可探测、可视、甚至可量化的信息。然而,不论技术发展有多么进步,人类仍然保留着根植于基因中的本性,用自身最精确也最可靠的感知手段来接收信息——眼见为实。自列文虎克发明显微镜以来,人类不断改进工具拓展自身的视野。但物理学定律横亘在人类面前,即使是阿贝本人也不愿承认那看似不可逾越的极限。幸运的是,人类的头脑总能找到方法,在物理学的规矩之内找到突破口,完成对自身极限的跨越。2014年诺贝尔化学奖便是颁发给三位为超分辨率(Super-resolution)荧光显微镜的发展做出突出贡献的科学家,以表彰其为人类跨越光学衍射极限和显微镜分辨率极限所做出的努力。
在三位获奖人之外,哈佛大学华人科学家庄小威教授同样在超分辨率成像技术的开发和应用领域有着重要和突出的贡献。在2019年8月30日,庄小威教授实验室在Science杂志上发表了题为Membrane-associated periodic skeleton is a signaling platform for RTK transactivation in neurons的文章,报道了其利用超分辨率成像技术完成的一项新发现。在文章中,作者直接观察到了细胞膜受体与细胞膜下的蛋白骨架结构的相互作用,并验证了这一相互作用对受体下游信号通路的调控机制。

在之前的研究中,庄小威实验室已经利用超分辨率成像技术成功识别了神经元细胞中位于细胞膜下的一层由肌动蛋白(Actin)、血影蛋白(Spectrin)等组装而成的具有周期性排列的骨架结构(Membrane-associated Periodic Skeleton, MPS)【1,2】。超分辨率成像技术在研究中起到了关键作用,成功得解析了常规显微镜无法分辨的细胞内精细结构(图1)。在此基础上,作者在本文中进一步发现,在超分辨率显微镜下可以观察到多种细胞膜蛋白与MPS成分蛋白的共定位(Co-localization)。这些膜蛋白中包括G蛋白耦联受体CB1和细胞粘附分子NCAM1,而二者均已被证明可以间接激活络氨酸激酶受体(Receptor Tyrosine Kinase, RTK)的功能。
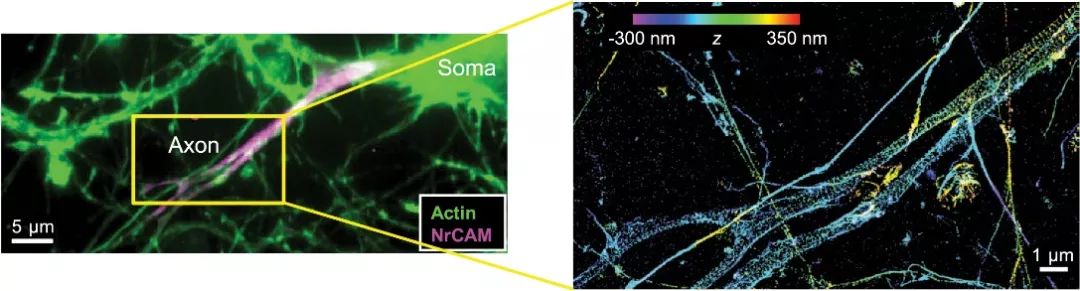
图1 常规荧光显微镜与超分辨率荧光显微镜(STORM)成像对比
在蛋白共定位的基础上,作者发现激活CB1和NCAM1可以促使其与MPS成分蛋白的共定位增加,而选择性抑制MPS则可以抵消激活前者带来的效果(图2)。这一实验证明了CB1和NCAM1的功能很可能决定于它们与MPS的相互作用。之后作者进一步证明了CB1和NCAM1对于RTK及其下游Erk信号通路的激活同样需要MPS参与。受到这一启发,作者再次使用超分辨率成像对RTK受体蛋白以及介导其下游信号通路的Src蛋白的定位进行了观察,发现这些蛋白同样与MPS以及CB1/NCAM1具有共定位,并且共定位同样受到CB1/NCAM1激动剂和MPS抑制剂的影响(图2)。由此,作者证明MPS可以募集多种RTK相关蛋白,并藉此促进其相互作用,完成RTK受体的激活。
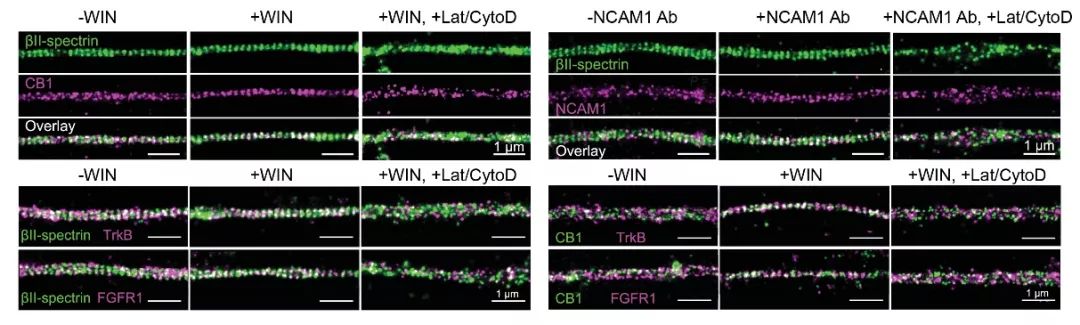
图2 RTK信号相关蛋白与MPS的共定位
在观察到MPS介导的RTK受体激活后,作者进一步发现受体激活后MPS结构将在一定程度上被降解,而这一降解过程受RTK下游Erk信号通路正向调节。由于MPS降解后其募集的蛋白之间的稳定性降低,MPS的降解促进了内吞作用介导的RTK受体的回收和下游信号的减弱。经过这一系列过程,细胞利用MPS对RTK受体相关蛋白的募集和MPS的降解完成了受体信号激活——下游信号通路激活——受体回收——下游信号通路减弱这一经典的负反馈环路(图3)。
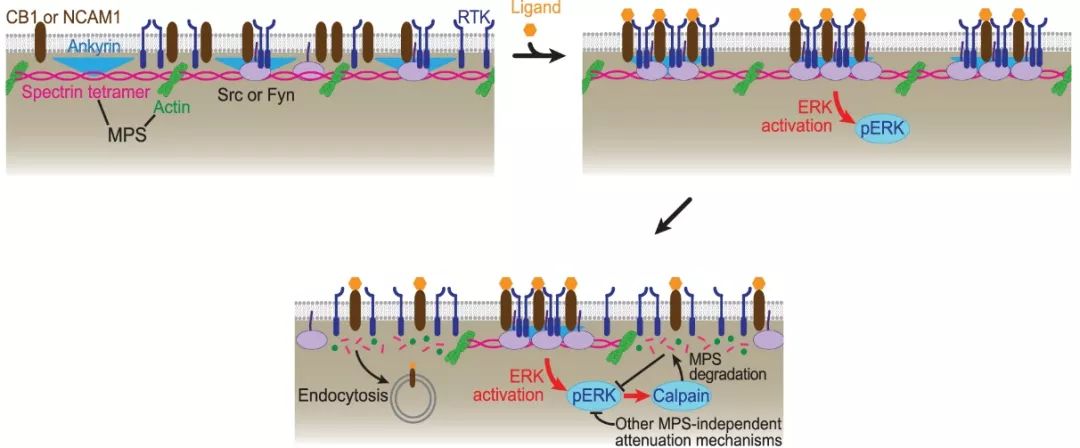
图3 MPS介导RTK信号激活和负反馈调节模式图
综上所述,庄小威实验室利用超分辨率成像技术对膜受体信号通路及其负反馈调节这一教科书级别的生物过程进行了重新“审视”,并发现了一条全新的介导这个过程的机制。利用分辨率的优势,研究者得以直接观察以往无法观察到的亚细胞结构,并通过观察结果更加直接的提出假设,“捅破”遗传或生物化学结果与细胞生物学过程间的“窗户纸”。相信随着超分辨率成像技术的普及,更多的难题可以被破解,更多的科学问题可以得到更精确的解答。
原文链接:
https://science.sciencemag.org/content/365/6456/929
参考文献
1. K. Xu, G. Zhong, X. Zhuang. Actin, spectrin, and associated proteins form a periodic cytoskeletal structure in axons. (2013) Science. 339, 452-456.
2. B. Han, R. Zhou, C. Xia, X. Zhuang. Structural organization of the actin-spectrin-based membrane skeleton in dendrites and soma of neurons. (2017) Proc. Natl. Acad. Sci. U.S.A. 114, E6678-E6685.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652474651&idx=3&sn=8607ad499bc407bd609b23d4f16c2d17&chksm=84e21eafb39597b90895cf25f1a01a4a9a81eb237251c68a9f962539a964419236e950a0997e&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn


