来源:BioArt
原标题: Plos Biol:蒋若天组揭示星形胶质细胞是全身麻醉药物导致发育期神经毒性的关键靶点
全球每年有数百万婴幼儿接受全身麻醉,前期回顾性队列研究和临床前研究均提示发育期个体接受全麻药物暴露将影响神经系统发育,表现为行为异常、学习记忆能力障碍。基于此,在2016年,美国食品药瓶监督局(FDA)发布警告:3岁以下婴幼儿或妊娠晚期孕妇需谨慎接受长时间或重复性的全麻(以及镇静)药物暴露(https://www.fda.gov/Drugs/DrugSafety/ucm532356.htm)。近年来发表的高质量的临床研究GAS【1】,PANDA【2】以及MASK【3】研究提示短时间单次麻醉暴露不会影响儿童大脑发育,但同时MASK研究也发现长时程或反复多次麻醉暴露将影响儿童神经系统发育。
然而,关于全身麻醉药导致的神经发育异常的背后机制尚不明确。早期研究主要集中于神经元凋亡,但神经元凋亡仅在暴露后短时间出现,且只有少于2%神经细胞出现凋亡,神经元凋亡是否导致成年期认知功能障碍并不明确。最近研究更关注全身麻醉药物暴露导致的神经环路发育异常,表现为神经元突起生长异常,树突棘数量改变,突触数量和结构改变,突触可塑性受抑制以及突触传递障碍等【4,5】。星形胶质细胞参与调节突触的形成、修剪和功能,对正常神经环路的形成至关重要。然而,全身麻醉药物是否导致发育期星形胶质细胞的结构和功能障碍,进而介导神经环路发育及神经行为异常尚未可知。
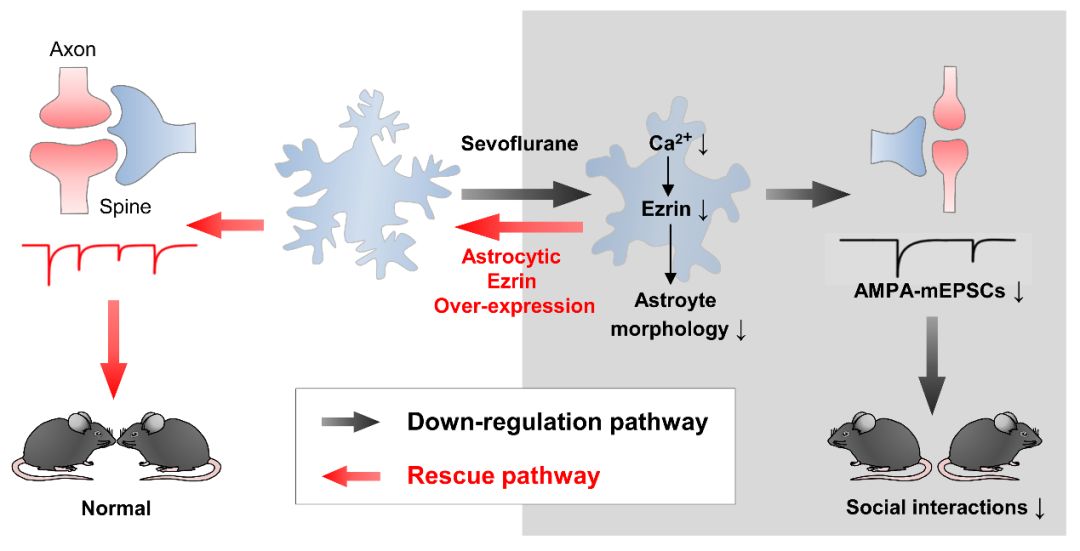
2019年8月21日,四川大学华西医院麻醉与危重急救研究室/麻醉科蒋若天团队在PLoS Biol上在线发表了Astroglialdysfunctions drive aberrant synaptogenesis and social behavioral deficits inmice with neonatal exposure to lengthy general anesthesia 的研究成果。该研究以小儿外科常用的吸入麻醉药物——七氟烷(Sevo)建立动物模型,揭示了长时程(4h)Sevo暴露通过抑制星形胶质细胞钙信号,导致肌动蛋白结合蛋白——Ezrin表达下降,从而引起星形胶质细胞精细形态缺失,并导致突触发育异常和社交障碍。通过表达星形胶细胞的Ezrin,可挽救Sevo导致的星形胶质细胞和突触发育异常,并逆转社交障碍。

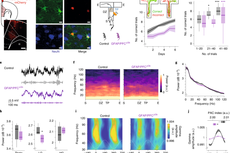
研究人员首先利用单细胞荧光标记及3D形态重建等技术,证实了长时间Sevo暴露引起发育期小鼠感觉皮层内星形胶质细胞精细形态缺失,并呈现区域特异性、暴露时长依赖性和发育期特异性。其后,用连续块面扫描电镜(SBF-SEM)对星形胶质细胞和突触进行了3D重构,发现Sevo抑制了星形胶质细胞-神经元空间联系的形成。研究还发现,Sevo导致小鼠感觉皮层内未成熟突触密度增加,但AMPA受体介导的兴奋性突触传递功能下降,且引起了小鼠在青春期的社交障碍。此外,Sevo导致的星形胶质细胞形态缺失与突触发育异常存在时空上的联系,因而推测星形胶质细胞可能是Sevo介导发育期神经毒性的重要靶点。
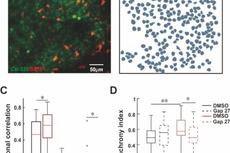
星形胶质细胞的诸多生理功能受胞内Ca2+的调控,为此,研究人员进行了星形胶质细胞钙成像,并发现Sevo能够抑制星形胶质细胞的钙信号,包括自发钙信号、激发钙信号和基础钙水平。通过文献筛查,研究人员锁定了钙下游与星形胶质细胞形态相关的蛋白Ezrin,证实了在发育期,Ezrin表达在星形胶质细胞中,并逐渐富集于星形胶质细胞的精细分支上,而长时间Sevo暴露导致小鼠感觉皮层内Ezrin表达下调。
为了探究星形胶质细胞胞内Ca2+—Ezrin—形态之间的关系,研究人员通过螯合星形胶质细胞的胞内Ca2+或利用AAV病毒介导的miRNA干扰技术下调星形胶质细胞的Ezrin表达,二者均能模拟Sevo介导的星形胶质细胞形态缺失,阐明了Ezrin是调控星形胶质细胞形态发育的重要分子。
最后,通过上调发育期小鼠脑皮质的Ezrin表达,不仅恢复了Sevo引起的星形胶质细胞和突触发育异常,还纠正了Sevo介导的社交障碍。该研究证实了星形胶质细胞是全身麻醉药物介导发育期神经毒性的关键靶点,阐明了星形胶质细胞形态的完整性是维持突触发育和神经行为的重要机制。
四川大学华西医院麻醉与危重症研究室蒋若天研究员为该论文通讯作者。四川大学华西医院麻醉与危重症研究室周斌、陈玲敏博士为该论文共同第一作者。
原文链接:
https://doi.org/10.1371/journal.pbio.3000086
参考文献
1. McCann ME, de Graaff JC, Dorris L, Disma N,Withington D, Bell G, et al. Neurodevelopmental outcome at 5 years of age aftergeneral anaesthesia or awake-regional anaesthesia in infancy (GAS): aninternational, multicentre, randomised, controlled equivalence trial. Lancet.2019;393(10172):664-77. doi: 10.1016/S0140-6736(18)32485-1. Epub 2019 Feb 14.
2. Sun LS, Li G, Miller TL, Salorio C, ByrneMW, Bellinger DC, et al. Association Between a Single General AnesthesiaExposure Before Age 36 Months and Neurocognitive Outcomes in Later Childhood.JAMA. 2016;315(21):2312-20. doi: 10.1001/jama.2016.6967.
3. Warner DO, Zaccariello MJ, Katusic SK,Schroeder DR, Hanson AC, Schulte PJ, et al. Neuropsychological and BehavioralOutcomes after Exposure of Young Children to Procedures Requiring GeneralAnesthesia: The Mayo Anesthesia Safety in Kids (MASK) Study. Anesthesiology.2018;129(1):89-105. doi: 10.1097/ALN.0000000000002232.
4. Vutskits L, Xie Z. Lasting impact of generalanaesthesia on the brain: mechanisms and relevance. Nat Rev Neurosci.2016;17(11):705-17. doi: 10.1038/nrn.2016.128.
5. Kang E, Jiang D, Ryu YK, Lim S, Kwak M, GrayCD, et al. Early postnatal exposure to isoflurane causes cognitive deficits anddisrupts development of newborn hippocampal neurons via activation of the mTORpathway. PLoS Biol. 2017;15(7):e2001246. doi: 10.1371/journal.pbio..eCollection 2017 Jul.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652474325&idx=5&sn=0e6d61fb3a20c057e82988dd3ca31d48&chksm=84e21861b39591772ed2c5f168acfdd316fa075b5d107838e67fb0a15c123946329ab5ade9be&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn