来源:BioArt
肠道菌群是定居在人体肠道内的庞大细菌群体。肠道菌群具有强大的代谢能力,其种类繁多的代谢产物可影响宿主发育和生理功能【1,2】。近年来,越来越多的研究揭示了肠道菌群和宿主健康之间的关系,然而在分子层面的调控机理还有待更详细的研究,人类及其肠道菌群的复杂性限制了对肠道菌群如何影响宿主发育这一问题的系统性研究。秀丽隐杆线虫(Caenorhabditis elegans)及其共生的细菌是研究细菌-宿主相互作用的理想在体模式系统。
2019年8月20日,马萨诸塞州立大学医学院(UMass Medical School)系统生物学系Marian Walhout 实验室在Cell Host & Microbe杂志上发表文章A Delicate Balance between Bacterial Iron and Reactive Oxygen Species Supports Optimal C. elegans Development 。该研究以秀丽隐杆线虫及大肠杆菌为研究对象,报道了244种大肠杆菌突变体可导致秀丽隐杆线虫发育减缓,并发现大肠杆菌突变体中的较低的铁含量是导致秀丽隐杆线虫发育减缓的原因。

为鉴别出影响秀丽隐杆线虫发育的细菌代谢产物,在这项研究中,Walhout课题组研究人员建立了一套高通量筛选系统,对大肠杆菌进行了全基因组筛选。通过大规模筛选近4000个大肠杆菌单基因敲除突变体,发现244个大肠杆菌基因被单个敲除后,可导致秀丽隐杆线虫的发育变缓。随后,研究人员对这244个大肠杆菌基因的功能和类别进一步分析,发现这些基因参与了不同的细胞进程,如电子传递链和铁的运输等。
电子传递链复合物在电子传递过程中会产生活性氧(ROS),检测发现大肠杆菌电子传递链突变体中ROS的含量升高,并且秀丽隐杆线虫的发育变缓的表型可被抗氧化剂所拯救,表明大肠杆菌电子传递链突变体中的ROS水平升高导致秀丽隐杆线虫的发育变缓。
微量元素铁是构成人体的必不可少的元素之一,铁参与了氧气运输,能量代谢,DNA合成和转录调控等重要生理过程【2】。过高或过低的铁含量都会导致ROS水平升高,维持生物体内的铁含量的稳定对生物体的发育尤为重要。大肠杆菌中铁运输相关的突变体也可导致秀丽隐杆线虫的发育速率变缓,该表型可被添加的铁所拯救,表明大肠杆菌铁运输相关的突变体中的低浓度的铁是导致秀丽隐杆线虫的发育变缓的原因。
研究人员发现,大多数大肠杆菌突变体中的ROS水平均有所升高。为验证这些大肠杆菌突变体中的高水平的ROS是否为秀丽隐杆线虫的发育变缓的直接原因,研究人员检查发现无ROS的大肠杆菌突变体的粉末仍可减缓秀丽隐杆线虫的发育,暗示ROS并非发育变缓的直接原因,ROS水平升高可引起大肠杆菌中其他代谢产物的变化,从而减缓秀丽隐杆线虫的发育。
文献报道, ROS可以与铁发生Feton 反应,产生危害更大的活性氧。当细菌中ROS水平升高时,为降低Fenton反应造成的危害,细菌可调控降低细菌体内铁含量【4】。添加铁可以拯救大肠杆菌突变体所导致的线虫的发育变缓,暗示大肠杆菌突变体中ROS水平升高导致了铁含量降低,从而导致线虫的发育变缓。
为了进一步解释为何敲除功能各异的基因都造成了ROS的变化,研究人员对52个影响秀丽隐杆线虫发育的大肠杆菌代谢基因进行了代谢网络建模分析(metabolic network modeling)。通过分析这些基因对大肠杆菌代谢流(metabolic flux)的影响,研究人员发现这些基因在代谢网络中形成了一个紧密关联的子网络,这一子网络可以通过影响氧化磷酸化的代谢水平或者多种还原性代谢物(如谷胱甘肽)的生物合成来进一步导致ROS的积累。这一分析为许多非直观的基因突变是如何影响大肠杆菌体内ROS水平提供了新的见解。
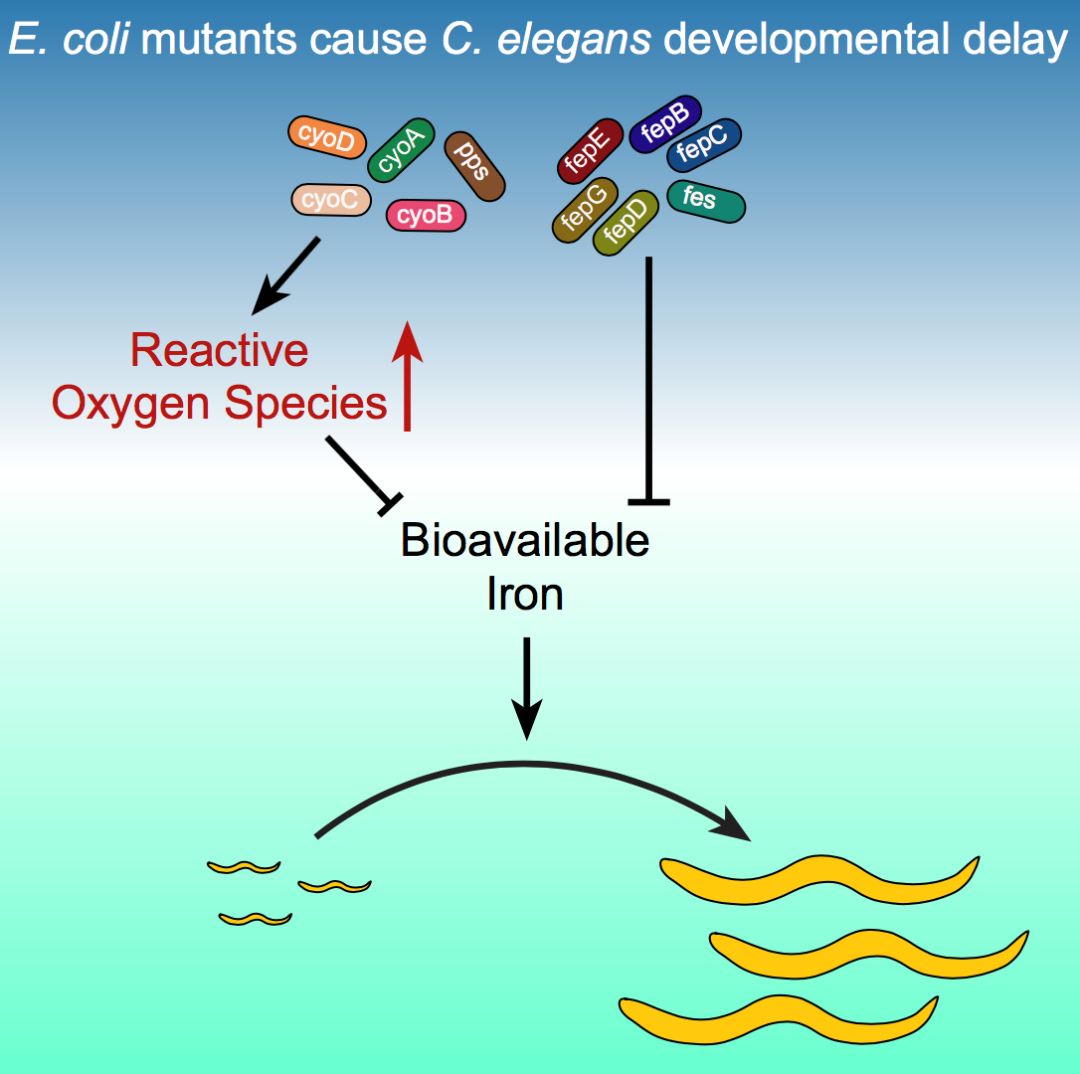
图1. 大肠杆菌突变体导致秀丽隐杆线虫发育速率减缓的调控机制
该项研究首次系统研究了共生细菌与秀丽隐杆线虫生长发育的关系,发现大肠杆菌中244个基因被敲除后,能够显著减缓宿主秀丽隐杆线虫的发育;证明大肠杆菌突变体中ROS水平升高所导致的铁含量减低是减缓秀丽隐杆线虫的发育的直接原因;并且通过生物信息学的方法,对大肠杆菌代谢流进行分析,为进一步阐明大肠杆菌中ROS的生成机制提供了基础。
麻省大学医学院系统生物学系博士后张景彦博士为本文的第一作者,在读博士生李旭航为本文的第二作者。
原文链接:
https://doi.org/10.1016/j.chom.2019.07.010
参考文献
1. Oliphant, K., & Allen-Vercoe, E.(2019). Macronutrient metabolism by the human gut microbiome: majorfermentation by-products and their impact on host health. Microbiome, 7(1),91.
2. Sharon, G., Garg, N., Debelius, J.,Knight, R., Dorrestein, P. C., & Mazmanian, S. K. (2014). Specializedmetabolites from the microbiome in health and disease. Cell metabolism, 20(5),719-730.
3. Wang, J., & Pantopoulos, K. (2011).Regulation of cellular iron metabolism. Biochemical Journal, 434(3),365-381.
4. Cornelis, P., Wei, Q.,Andrews, S. C., & Vinckx, T. (2011). Iron homeostasis and management ofoxidative stress response in bacteria. Metallomics, 3(6),540-549.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652474161&idx=4&sn=8ae4c296ac510a742aee0a00ef2519bf&chksm=84e21885b39591939de2bc7e944c960f12d962b91cb4a23cf619875c5c6540a79731bb5a5600&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn


