来源:BioArt
白血病(Leukemia)是一种血液系统癌症,表现为骨髓、血液以及其他组织被无限增殖的不成熟的造血细胞浸润,抑制正常的造血功能。髓系白血病(Myeloid Leukemia, ML)是指粒细胞、单核细胞、红细胞或巨核系发生病变的白血病【1】。ML是儿童中出现频率最高的癌症,而患有唐氏综合征(Down syndrome, DS)的儿童ML的发病率是正常儿童的150倍【2】。伴随DS的ML(ML-DS)患儿在患病前往往出现一个特殊的阶段,称为短暂性异常骨髓增殖(transient abnormal myelopoiesis, TAM)。30%的唐氏综合征儿童造血干细胞中转录因子GATA1发生突变最终导致TAM,其中又有20%的儿童中GATA1突变的细胞又获得其他突变,在5年内使TAM发展为ML-DS【3】。
为确定TAM和ML-DS的发生机制,已有多项工作对TAM和ML-DS阶段的癌细胞进行测序【4-6】。TAM阶段的癌细胞GATA1均发生突变;ML-DS阶段除了保留GATA1突变外,突变大多发生在编码黏连蛋白组分,表观遗传调控蛋白,以及JAK,PI3K-AKT,RAS信号通路组分的基因中。但这些基因是否在TAM发展为ML-DS过程中发挥作用,依旧缺乏系统的鉴定。
近日,来自德国马丁路德·哈勒维腾贝格大学的Jan-Henning Klusmann团队,来自汉诺威医学院的Dirk Heckl与来自英国牛津大学Paresh Vyas团队共同在Cancer Cell杂志上发表文章——Mechanisms of Progression of Myeloid Preleukemia to Transformed Myeloid Leukemia in Children with Down Syndrome。作者通过分析111位TAM和141位ML-DS病人样本的基因序列,证明了21染色体三倍性和GATA1失活突变足以导致TAM的发生,同时鉴定了ML-DS新的热点突变CSF2RB(A455D)。并且,作者成功建立TAM转化ML的小鼠模型并鉴定18个转化过程中发挥重要作用的基因,从而为研究转化过程的机制奠定了基础。

作者首先使用三种方法对111位TAM和141位ML-DS病人的外周血和骨髓样本的基因组序列(其中包括12个成对的TAM和ML-DS样本)进行分析,分别是全外显子测序,使用RNA捕获的定向测序和基于扩增子捕获靶向序列测序。与之前报道类似,在ML-DS的样本中,突变多发生在编码黏连蛋白复合体的基因,包括STAG2,RAD21, SMC1A, SMC3, CTCF和NIPBL(占比47%),JAK家族基因MPL和KIT(占比48%),表观遗传调控基因KANSL1,EZH2,SUZ12(占比36%)和Ras家族基因中(占比20%)。此外,作者鉴定到新的热点突变CSF2RB(A455D/T),占比4.7%(图1)。通过分析疾病发展过程中的基因突变率,作者发现28%的突变并非发生在所有的癌细胞中。而编码黏连蛋白复合体核心亚基的基因和JAK家族基因的突变更可能发生在所有癌细胞中。特别地,CSF2RB(A455D)在突变的样本中均存在于所有的癌细胞中。
而在TAM样本中,基因突变的发生率明显低于ML-DS样本。除所有样本的GATA1均突变失活外,并无其他突变与ML-DS样本的突变不同(图1),并且双荧光素酶报告实验表明这些突变不影响STAT5的活性,这说明TAM样本中除GATA1外的其他突变对TAM的发生无决定作用,即仅有GATA1突变为白血病前期发生所必需。
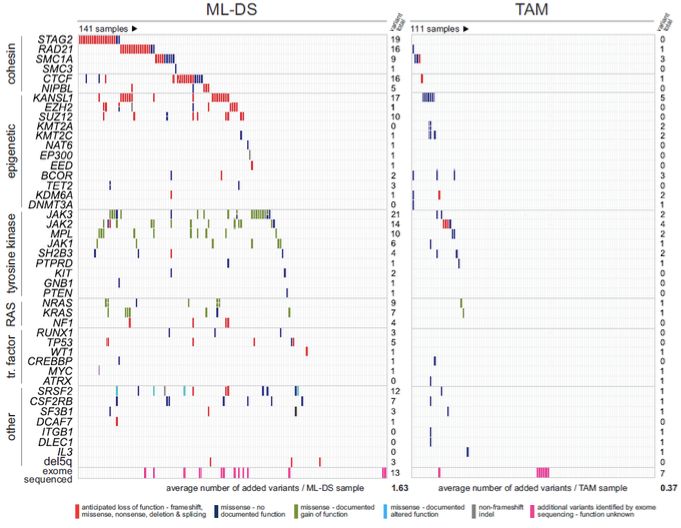
图1:ML-DS和TAM样本中基因突变图谱。
作者进一步鉴定了首次发现的突变CSF2RB(A455D)在TAM转化到ML-DS过程中的作用。CSF2RB能够与受体特异的α链和细胞因子形成复合体,介导JAK,PI3K-AKT-mTOR和MEK/ERK信号通路的激活,调控造血细胞的存活,增殖和分化【7】。位于跨膜区的丙氨酸替换为带负电的天冬氨酸(A455D)进而促进与自身和受体α链二聚化,从而持续激活下游信号。作者发现,CSF2RB(A455D)能够促进人白血病细胞系TF1在无GM-CSF环境下增殖(图2A),并增加移植TF1细胞小鼠的死亡率。CSF2RB(A455D)还抑制造血细胞的分化为成熟的巨核细胞(CD41+/CD42b+)(图2B),而使用JAK抑制剂ruxolitinib能够回复这种效应,说明突变CSF2RB(A455D)激活JAK信号通路,诱导癌变发生。
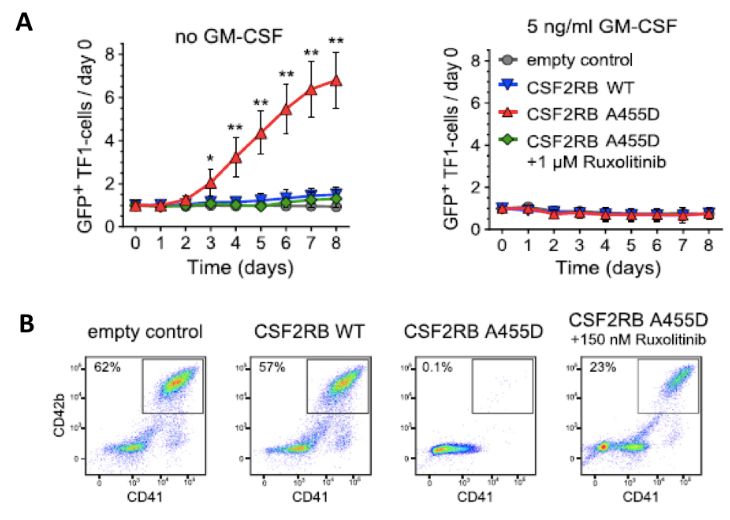
图2:CSF2RB(A455D)调控JAK2进而促进造血细胞增殖(A)并抑制分化(B)。
为揭示由TAM到ML-DS的转化过程,作者在小鼠胚胎肝细胞中使用靶向Gata1的第二外显子的CRISPR-Cas9系统敲除Gata1,并将胎肝细胞移植到骨髓被清除的受体小鼠中,成功构建能够模拟TAM的模型(图3A)。作者针对临床样本中检测到突变的基因设计gRNA,将gRNA混合后导入胎肝细胞,移植到小鼠中。通过对38只发生ML的小鼠癌细胞进行测序,发现82% (18/22) 能够与Gata1协同调控TAM到ML-DS的转化过程(图3B)。
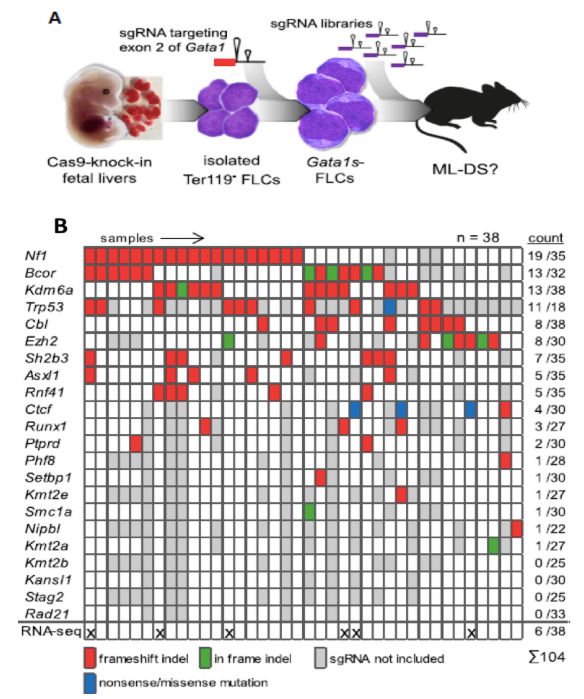
图3:敲除Gata1的小鼠胚胎干细胞产生模拟ML-DS的白血病。
综上,作者分析了111位TAM和141位ML-DS病人的外周血和骨髓样本的基因组序列,发现仅有GATA1突变为白血病前期发生所必需;同时还鉴定了ML-DS新的热点突变CSF2RB(A455D)。作者又建立了TAM转化到ML的小鼠模型,使用该模型鉴定得到18个在其中发挥重要作用的基因,从而为研究转化过程奠定了基础,未来可为控制唐氏综合征儿童白血病的发生提供新的策略。
本文通讯作者是马丁路德·哈勒维腾贝格大学儿童血液和肿瘤系的Jan-Henning Klusmann,汉诺威医学院儿童血液和肿瘤科的Dirk Heckl,与牛津大学血液学系Paresh Vyas教授。Maurice Labuhn, Kelly Perkins为本文共同第一作者。
原文链接:
https://doi.org/10.1016/j.ccell.2019.06.007
参考文献
[1].Lowenberg B, Downing JR,Burnett A. Acute myeloid leukemia [J]. N Engl J Med, 1999. 341(14): 1051-1062
[2].Hasle H, Clemmensen IH,Mikkelsen M. Risks of leukaemia and solid tumours in individuals with Down's syndrome [J]. Lancet, 2000. 355(9199): 165-169
[3].Roberts I, Alford K, Hall G, et al. GATA1-mutant clones are frequent and often unsuspected in babies with Down syndrome: identification of a population at risk of leukemia [J]. Blood, 2013. 122(24): 3908-3917
[4].Andersson AK, Ma J, Wang J, et al. The landscape of somatic mutations in infant MLL-rearranged acute lymphoblastic leukemias [J]. Nat Genet, 2015. 47(4): 330-337
[5].Ma X, Liu Y, Liu Y, et al. Pan-cancer genome and transcriptome analyses of 1,699 paediatric leukaemias and solid tumours [J]. Nature, 2018. 555(7696): 371-376
[6].Yoshida K, Toki T, Okuno Y, et al. The landscape of somatic mutations in Down syndrome-related myeloid disorders [J]. Nat Genet, 2013. 45(11): 1293-1299
[7].Broughton SE, Nero TL, Dhagat U, et al. The betac receptor family - Structural insights and their functional implications [J]. Cytokine, 2015. 74(2): 247-258
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652474055&idx=4&sn=8094692b2e8eb60f2e06d8490fe1324b&chksm=84e21973b3959065e40a7e7fc5fdf11e918af2546cb8fe91c8aaa22ab82742de00bcd047fb14&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



