来源:BioArt
原标题:Molecular Cell: 浙大王迪团队揭示氨基酸代谢调控炎症性巨噬细胞活化的免疫代谢新机制...
所有细胞类型都可以通过调控其内部的代谢途径支持其发挥细胞类型特异性功能,免疫细胞也不例外。免疫细胞根据其执行不同的免疫功能或者免疫反应的不同阶段构建和偏好不同的代谢物质生化基础 (biochemical underpinnings) ,从而帮助其更好地发挥免疫应答并维持免疫稳态的平衡。炎症性巨噬细胞 (inflammatory macrophages) 的活化在炎症性疾病中发挥重要作用,研究不同类型的代谢物质生化基础、代谢途径偏好、以及营养物质供给 (nutrient availability) 在巨噬细胞活化中的调控功能将为全面了解巨噬细胞炎症反应提供重要的理论基础。
浙江大学基础医学院王迪团队一直关注巨噬细胞的代谢调控机制,特别是IL-1β的转录、翻译和成熟切割。2019年8月13日,王迪团队联合武汉大学生科院吴英亮团队(共同第一作者为博士生余伟伟、王振、张凯莲)在Molecular Cell杂志在线发表题为One-carbon metabolism supports S-adenosylmethionine and histone methylation to drive inflammatory macrophages的研究论文,该研究系统地揭示了在LPS刺激条件下,葡萄糖、氨基酸、核苷酸等如何协同 (synergistically) 支持免疫代谢物S-腺苷甲硫氨酸 (SAM) 的产生,进而通过重塑表观调控促进炎症因子如IL-1β的转录表达。

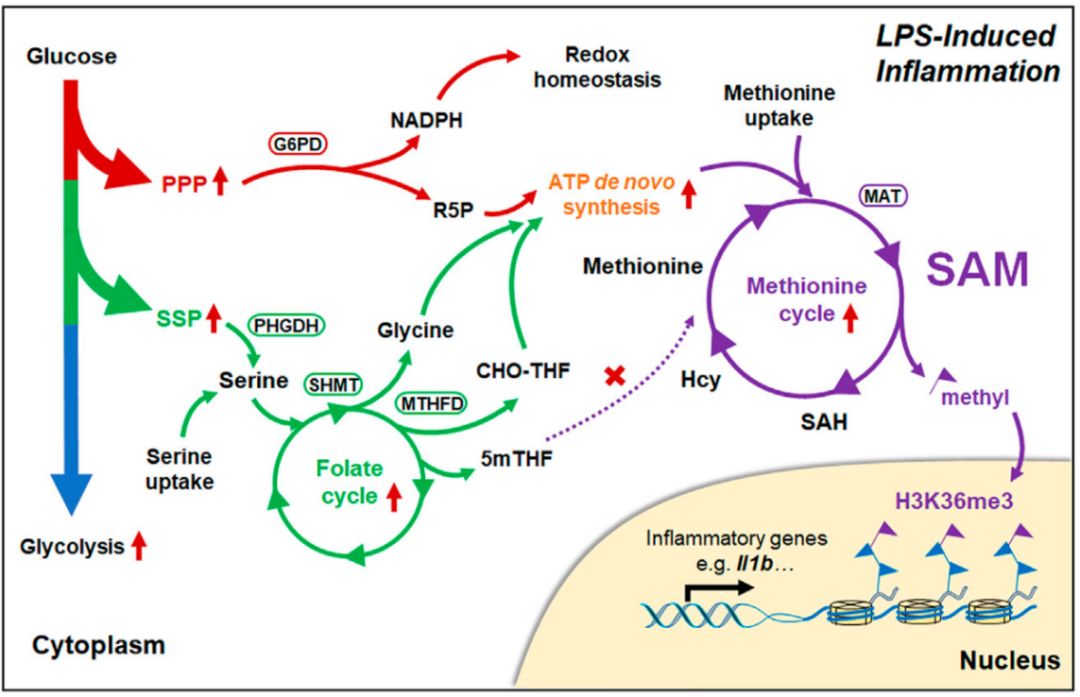
研究人员首先通过代谢组学和转录组学分析,发现除了已知的有氧糖酵解 (aerobic glycolysis) 代谢产物以及三羧酸循环断裂 (broken TCA cycle) 代谢产物琥珀酸 (succinate) 和衣康酸 (itaconate) 迅速累积外,LPS刺激巨噬细胞后其糖酵解支路 (glycolysis offshoot) 包括磷酸戊糖途径(PPP)和丝氨酸合成途径 (SSP) ,以及重要的代谢网络丝氨酸/甘氨酸/一碳代谢 (serine/glycine/one-carbon, SGOC) 迅速增强。
为了系统分析葡萄糖、丝氨酸等来源的碳原子的代谢流向以及它们的协同功能,研究人员利用代谢流技术发现LPS促进葡萄糖来源的碳原子分别通过PPP途径产生核糖 (ribose) ,SSP途径生成丝氨酸、甘氨酸、一碳单位 (1C unit) ,进而促进ATP从头合成 (ATP de novo synthesis) 生成ATP。研究人员进一步发现这种通过叶酸循环 (folate cycle) 来源的一碳单位并不能直接掺入到一碳代谢重要组成部分蛋氨酸循环 (methionine cycle) 中,而是需要外源蛋氨酸和ATP提供的嘌呤环 (purine ring) 协同生成细胞内最重要的甲基供体 (methyl donor) ,S-腺苷甲硫氨酸SAM。
在明确了LPS刺激条件下巨噬细胞中葡萄糖和丝氨酸的代谢流向后,研究人员通过大量特异性抑制剂和基因干预策略证实上述代谢通路对于体外和体内IL-1β等炎症因子的表达非常重要,但是对于TNF-α的转录表达没有影响。特定氨基酸饥饿培养发现外源蛋氨酸和丝氨酸对于炎症性巨噬细胞的活化非常重要,但是甘氨酸贡献很小。
由于SAM是细胞内最为重要的甲基供体,研究人员发现LPS刺激会促进H3K36me3的累积,而对其他类型的组蛋白甲基化修饰影响较小。更重要的是干扰上述代谢网络或通过蛋氨酸、丝氨酸饥饿培养的话,H3K36me3的表达受到显著抑制,说明H3K36me3在巨噬细胞活化过程中对SAM的依赖性最为明显。进一步的ChIP实验也证实SAM合成对于H3K36me3在炎症因子基因如Il1b等gene body区域的富集非常重要,最终促进一系列炎症因子的表达。
该研究系统阐明了葡萄糖、氨基酸、核苷酸代谢在LPS刺激条件下对炎症性巨噬细胞功能的协同代谢支撑作用,发现一系列具有潜在炎症抑制功能的小分子化合物,并在表观调控机制上给予领域内关于IL-1β和TNF-α有着完全不同的代谢调控敏感性一种新的解释。
原文链接:
https://doi.org/10.1016/j.molcel.2019.06.039
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652473920&idx=3&sn=14d9c585a1ccb5e1daa0068aee952378&chksm=84e219f4b39590e23a26efcb4a724bec0c476e69bbc5369d37b2be3d8eed7f5ec5778b88b16e&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

