来源:化学加
导读
近日,北京大学化学与分子工程学院王初课题组和陈兴课题组合作在《自然-化学生物学》(Nature Chemical Biology)杂志上发表论文,论文报道了他们利用新一代半胱氨酸糖探针,结合定量化学蛋白质组学技术,系统鉴定衣康酸在巨噬细胞内修饰位点,并揭示衣康酸对糖酵解负反馈调控发挥抗炎作用新机制的工作。
小分子代谢物和蛋白的相互作用在各种生物学过程中都发挥着至关重要的作用,发展化学蛋白质组学技术系统分析蛋白-代谢物相互作用网络可以促进对其生物学意义的理解。衣康酸是近年来在巨噬细胞中发现的一类具有显著抗炎活性的代谢小分子,但其抗炎机制尚不明确。由于衣康酸具有一个α,β不饱和羧酸的结构,理论上它可以通过迈克尔加成反应共价修饰到蛋白质的半胱氨酸残基上。
此前,两个课题组合作发现,用于非天然糖代谢标记的全乙酰化叠氮糖探针,在细胞中可以通过无酶催化形式标记蛋白质组中大量的半胱氨酸位点(Qin W., et al.Angew. Chem. Int. Ed.2018.)。基于该反应,两个课题组在本工作中合作开发了新一代特异性半胱氨酸标记糖探针1-OH-Az,并结合定量化学蛋白质组学技术,成功地在巨噬细胞蛋白质组中鉴定到260个衣康酸修饰的半胱氨酸位点。
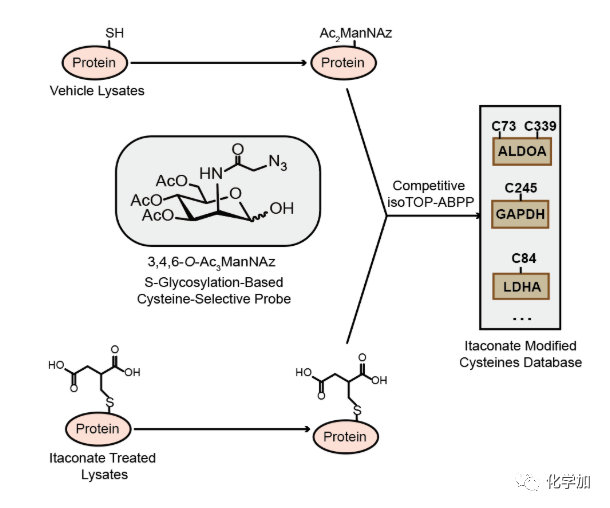
利用定量化学蛋白质组技术鉴定衣康酸靶点的示意图
作者进一步分析发现糖酵解中的三个关键酶ALODA,GAPDH和LDHA都可以被衣康酸修饰,其中最上游的ALDOA蛋白中两个半胱氨酸(Cys73和Cys339)上在被脂多糖刺激的巨噬细胞中发生了内源的衣康酸修饰。生化和细胞实验表明衣康酸可以通过修饰这两个半胱氨酸残基显著地抑制ALDOA的催化活性,进而抑制巨噬细胞内的糖酵解通路,从而发挥抗炎活性。

揭示衣康酸抗炎活性的新机制
该工作近日以“S-glycosylation-based cysteine profiling reveals regulation of glycolysis by itaconate”为题发表在《自然-化学生物学》杂志上(doi: 10.1038/s41589-019-0323-5),王初研究员和陈兴教授为该论文的共同通讯作者,论文第一作者为他们共同指导的交叉学院2014级研究生秦为。该工作获得基金委“生物大分子动态修饰与化学干预”重大研究计划和科技部“蛋白质机器与生命过程调控”重点专项等项目的资助。
来源:tryingchem 化学加
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwODA5MjQ3Ng==&mid=2653086144&idx=4&sn=07a3a7a0fd831def295d1563c4e16ca5&chksm=80a26f93b7d5e685b14d9cf4ae983ee6691719cb00c1216fef1df4a6cdbe2d5c3b871c709678&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn


