来源:ScienceAAAS
 周博闻(中科院昆明动物研究所)中科院青促会 王国栋(中科院昆明动物研究所) 评述论文:Somatic evolution and global expansion of an ancient transmissible cancer lineage(Science 2 August 2019: Vol 365, eaau9923 (2019))传染性肿瘤是自然界中存在的一类可以通过活细胞感染宿主(host)后增殖的一类肿瘤疾病,这打破了我们对肿瘤不能传染的固有认识。目前,已知的传染性肿瘤共有四种,分别是犬类生殖器传染性肿瘤(Canine transmissible venereal tumor,CTVT),袋獾面部肿瘤(Devil facial tumor disease, DFT1/DFT2),仓鼠传染性肿瘤(Hamsters reticulum cell sarcoma, HRCS),和软壳蛤白血病(Soft-shell clams leukemia,SSCL) (1, 2)。这些肿瘤是我们探寻大尺度时间范围内肿瘤进化的优秀材料,而CTVT是目前已知的最古老、传播最广泛的传染性肿瘤疾病(3)。 CTVT起源于数千年前一只名叫“CTVT founder”犬的体细胞,并在某种条件下获得了同种异体间“转移”的能力,在数千年的历史进程中,伴随着人类文明的更迭而幸存下来,并得以在全球范围广泛的克隆性传播(4),成为一种记录了古代犬科动物遗传信息的“活化石”,其演化历程也在近10年来被科学家们反复讨论。 本期Science杂志,来自英国剑桥大学Elizabeth P. Murchison等研究团队通过对43个国家的546例CTVT外显子组进行深度解析,重建了CTVT全球扩张模式。CTVT的系统发育分析显示,其起源于大约4000-8500年前中亚或北亚地区,并且在大约2000-6000年前,该疾病仅仅在这些地区流行。直到大约2000年前,CTVT才开始向欧洲和亚洲的其他地区扩散。在大约500年前,CTVT的一个支系进入中美洲,并进一步向北美和南美扩散,以至于该疾病至少五次引入非洲,并再次扩散至欧洲和亚洲地区。另一个CTVT支系则从亚洲或欧洲传播到澳大利亚和太平洋地区,该支系也同时扩散至北美地区并且两次引入非洲(图1)。有趣的是,之前对“CTVT founder”和世界各地的现代和古代家犬、灰狼、北美郊狼群体遗传分析发现,“CTVT founder”和北美土著家犬关系最接近,并携带一定比例来自北美郊狼和北美灰狼的基因流,而且北美家犬发生了群体替换,现生北美家犬来自欧洲家犬,没有携带任何北美土著家犬的组份(5, 6)。相信未来随着对CTVT研究的深入,CTVT可以为家犬迁徙历史和种群间杂交的解析提供新的思路和视角。
周博闻(中科院昆明动物研究所)中科院青促会 王国栋(中科院昆明动物研究所) 评述论文:Somatic evolution and global expansion of an ancient transmissible cancer lineage(Science 2 August 2019: Vol 365, eaau9923 (2019))传染性肿瘤是自然界中存在的一类可以通过活细胞感染宿主(host)后增殖的一类肿瘤疾病,这打破了我们对肿瘤不能传染的固有认识。目前,已知的传染性肿瘤共有四种,分别是犬类生殖器传染性肿瘤(Canine transmissible venereal tumor,CTVT),袋獾面部肿瘤(Devil facial tumor disease, DFT1/DFT2),仓鼠传染性肿瘤(Hamsters reticulum cell sarcoma, HRCS),和软壳蛤白血病(Soft-shell clams leukemia,SSCL) (1, 2)。这些肿瘤是我们探寻大尺度时间范围内肿瘤进化的优秀材料,而CTVT是目前已知的最古老、传播最广泛的传染性肿瘤疾病(3)。 CTVT起源于数千年前一只名叫“CTVT founder”犬的体细胞,并在某种条件下获得了同种异体间“转移”的能力,在数千年的历史进程中,伴随着人类文明的更迭而幸存下来,并得以在全球范围广泛的克隆性传播(4),成为一种记录了古代犬科动物遗传信息的“活化石”,其演化历程也在近10年来被科学家们反复讨论。 本期Science杂志,来自英国剑桥大学Elizabeth P. Murchison等研究团队通过对43个国家的546例CTVT外显子组进行深度解析,重建了CTVT全球扩张模式。CTVT的系统发育分析显示,其起源于大约4000-8500年前中亚或北亚地区,并且在大约2000-6000年前,该疾病仅仅在这些地区流行。直到大约2000年前,CTVT才开始向欧洲和亚洲的其他地区扩散。在大约500年前,CTVT的一个支系进入中美洲,并进一步向北美和南美扩散,以至于该疾病至少五次引入非洲,并再次扩散至欧洲和亚洲地区。另一个CTVT支系则从亚洲或欧洲传播到澳大利亚和太平洋地区,该支系也同时扩散至北美地区并且两次引入非洲(图1)。有趣的是,之前对“CTVT founder”和世界各地的现代和古代家犬、灰狼、北美郊狼群体遗传分析发现,“CTVT founder”和北美土著家犬关系最接近,并携带一定比例来自北美郊狼和北美灰狼的基因流,而且北美家犬发生了群体替换,现生北美家犬来自欧洲家犬,没有携带任何北美土著家犬的组份(5, 6)。相信未来随着对CTVT研究的深入,CTVT可以为家犬迁徙历史和种群间杂交的解析提供新的思路和视角。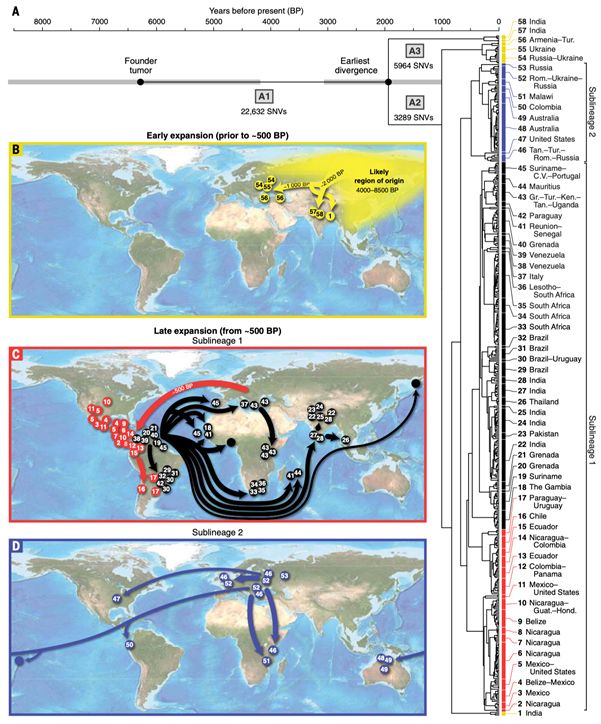
图1. CTVT系统发育树及全球扩张模式示意图
该团队通过对CTVT突变频谱的研究,提取出5个CTVT的突变特征(signature)(图2B)。其中,signature 1和signature 5反映了CTVT内源性突变过程,signature 7则是紫外线暴露造成的突变特征。同时新发现突变特征signature A,与转录协同作用下的DNA修复机制有关(transcription-coupled repair, TCR)。结合系统发育树的分析结果,作者探寻了CTVT时空特异性的突变特征,发现signature A在大多数现有CTVT样本中均不存在,一定程度上反映了早期CTVT创始群体的生活气候和环境条件,而signature 5则反映了CTVT创始群体生活区域的纬度(图2E)。根据作者的研究,CTVT的突变是一个多阶段的过程,相关突变的积累及紫外线暴露因素为“CTVT founder”的生存时间和地点提供了有价值的信息。故深入理解突变频谱背后的机制,结合群体遗传学的分析手段,可以深度挖掘家犬的复杂群体历史以及由此产生的复杂性状。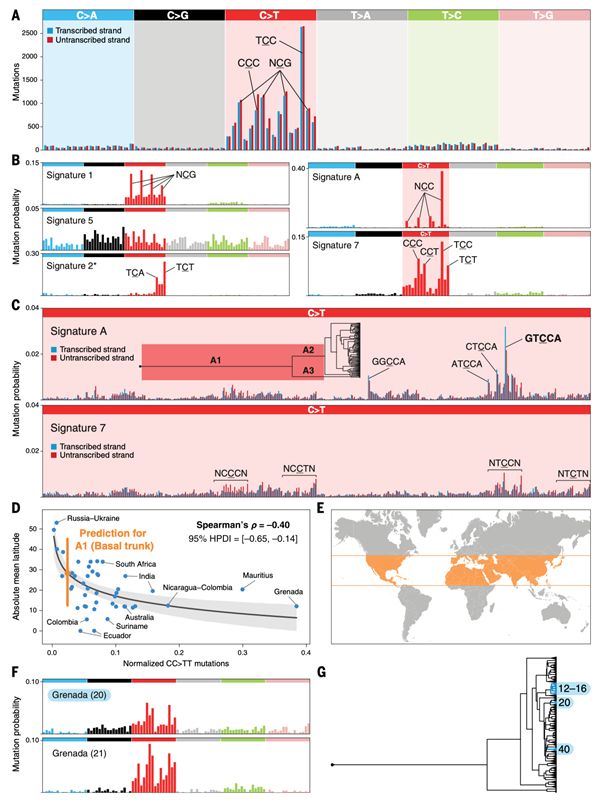
图2. CTVT突变特征
CTVT拥有巨大的突变负荷,超过了人类肿瘤。在外显子组测序的结果中,作者发现每例CTVT平均携带有37800 SNV,令人诧异的是,CTVT却能够存活至今并且逃脱宿主(host)的免疫监视,在同种不同个体间相互“传染”(7, 8)。此外,作者还筛选到了CTVT发生的早期突变可能驱动因素(SETD2, CDKN2A, MYC, PTEN和RB1),这些突变主要存在于CTVT发生的早期阶段,表明CTVT在早期已经获得了环境适应性。不同于人类癌症中以正选择为主导,CTVT主要是负选择起作用清除有害突变,这一选择作用可能帮助CTVT获得了同种异体间传播的能力。CTVT中的dN / dS分析结果大致为1,表明近中性进化。总而言之,CTVT在漫长的进化过程中已取得了非凡的成功,占据了其有利生态位,新突变的产生和积累反而会造成CTVT适应性的下降(图3)。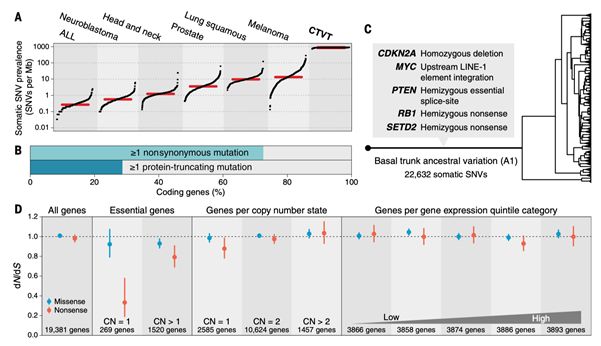
图3. CTVT受到的选择作用
CTVT不同于其他肿瘤随宿主死亡而一同凋亡,它拥有持续传播的特点,伴随着复杂的生活史。作者团队追踪了数千年CTVT的演变和迁徙过程,并将这一过程产生的突变和选择作用比较分析,得出结论中性进化是CTVT的主要进化驱动力。然而,作者提出CTVT中亚或北亚起源的理论以及早期CTVT的生活史是模糊的,目前普遍认为东亚南部代表了现代家犬的驯化起源地(9),所以需要继续收集这一地区的CTVT样品,重建更加完整,规模更大,历史更久的CTVT全球迁徙路线与进化历史。 述评人简介:周博闻中国科学院昆明动物研究所博士研究生 述评人简介:王国栋中国科学院昆明动物研究所研究员,中组部万人计划青年拔尖人才,中国科学院青年创新促进会会员。主要从事以家犬为主要研究对象的群体基因组学和复杂性状进化和遗传机制研究。参考文献
1. E. A. Ostrander, B. W. Davis, G. K. Ostrander, Transmissible tumors: breaking the cancer paradigm. Trends Genet. 32, 1-15 (2016).
2. M. R. Stammnitz et al., The origins and vulnerabilities of two transmissible cancers in tasmanian devils. Cancer Cell 33, 607-619.e615 (2018).
3. E. P. Murchison et al., Transmissible dog cancer genome reveals the origin and history of an ancient cell lineage. Science 343, 437-440 (2014).
4. A. Strakova, E. P. J. B. V. R. Murchison, The changing global distribution and prevalence of canine transmissible venereal tumour. BMC Vet. Res. 10, 168(2014).
5. M. Ní Leathlobhair et al., The evolutionary history of dogs in the Americas. Science 361, 81 (2018).
6. X. Wang et al., Canine transmissible venereal tumor genome reveals ancient introgression from coyotes to pre-contact dogs in North America. Cell Res. 29, 592-595 (2019).
7. C. Murgia, J. K. Pritchard, S. Y. Kim, A. Fassati, R. A. Weiss, Clonal Origin and Evolution of a Transmissible Cancer. Cell 126, 477-487 (2006).
8. D. Frampton et al., Molecular Signatures of Regression of the Canine Transmissible Venereal Tumor. Cancer Cell 33,620-633.e626 (2018).
9. G.-D.Wang et al., Out of southern East Asia: the natural history of domestic dogs across the world. Cell Res. 26, 21 (2015).
来源:Science-AAAS ScienceAAAS
原文链接:http://mp.weixin.qq.com/s?__biz=MzI3NDY3NzQ2Mg==&mid=2247487661&idx=5&sn=8e2eb8a1ecb49da3296b4bee20471020&chksm=eb113b14dc66b202f0b3eeb16f4be3d745b186803eeef16aefa4f9e948779e811542eab0329b&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



