来源:CBG资讯
循环肿瘤细胞(circulating tumor cell,CTC)是从肿瘤原发灶或转移灶脱落并游离到外周血中的一类肿瘤细胞,其容易引发肿瘤复发或转移并显著增加肿瘤患者的治疗难度和死亡风险。因此,CTC的有效检测对肿瘤的早期诊断、预后判断以及疗效监控等具有重要意义。然而,由于CTC在血液中含量极低,传统的基于“富集-检测”的两步分析法存在操作繁琐、灵敏度低、易产生假阴性等不足。如何实现全血中CTC的高灵敏直接检测是肿瘤诊疗领域的一个重大挑战。
福建物构所结构化学国家重点实验室陈卓团队和中科院功能纳米结构设计与组装重点实验室陈学元团队合作,在国家自然科学基金、中科院战略性先导科技专项、中科院创新国际团队以及福建省引进高层次创业创新人才等项目资助下,支持“率先行动”联合资助优秀博士后项目获得者宋晓荣博士和郭晗晗硕士等利用时间分辨稀土纳米荧光探针首次实现了全血中CTC的高灵敏直接检测。该稀土纳米荧光探针通过靶向上皮肿瘤细胞表面高度表达的表皮细胞粘附分子(EpCAM)实现对CTC的特异性高效识别。借助稀土纳米粒子(NaEuF4)的溶解增强荧光放大技术和长寿命的铕离子配合物红光荧光信号,该稀土纳米探针可有效克服复杂血液样品中短寿命背景荧光信号的干扰,极大地提高了CTC检测的灵敏度,其检测限低至1 CTC/well。同时,该检测策略具有优异的检测特异性和实用性。基于该检测策略,研究团队对不同临床分期的乳腺癌患者进行血液CTC水平分析,可实现93.9%的癌症阳性检出率(14/15),并且发现CTC检出水平与乳腺癌患者临床分期密切相关。该工作为全血中CTC直接检测研究提供了一个崭新思路,对实现肿瘤患者的早期诊断和预后监测具有重要意义。相关成果近日在线发表于化学领域顶级期刊《德国应用化学》( Angew. Chem. Int. Ed. 2019, DOI: 10.1002/anie.201907605),物构所/福建农林大学联培生郭晗晗硕士是该论文的第一作者,陈卓研究员、陈学元研究员和宋晓荣博士为通讯作者。该工作与福建省肿瘤医院乳腺肿瘤外科雷雯医生团队及病理科何诚医生在患者样本采集、CTC商用肿瘤细胞尺寸分离法(ISET)检测进行合作。
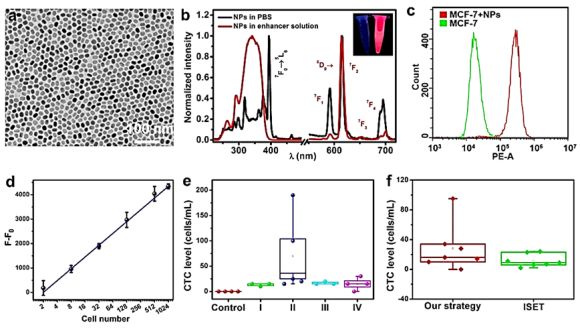
图1、a)NaEuF4纳米粒子电镜表征图;b)纳米粒子在磷酸盐缓冲液与增强液中的发射光谱与紫外灯照射下的发光照片;c)MCF-7乳腺癌细胞与纳米探针结合前后的流式细胞分析;d)时间分辨荧光信号与CTC浓度的线性关系;e)不同分期乳腺癌患者的血液CTC箱式统计分析图;f)基于稀土纳米探针与商用ISET检出的CTC水平比较。
(来源:Angew. Chem. Int. Ed. )
此前,陈卓团队和陈学元团队合作,在基于稀土上转换发光纳米材料的生物医学应用研究方面取得了一系列重要进展,例如,开发了基于上转换发光纳米探针的肿瘤标志物体外检测平台(Nanoscale 2015, 7, 4274-4290;封面文章)和深部抗菌抗真菌等光动力学治疗应用研究(Nanoscale 2018, 33, 15485-15495;内封面文章)。
来源:BeanGoNews CBG资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzI4ODQ0NjUwMg==&mid=2247495931&idx=3&sn=2b619948bb50659c5b2fe04ce6747fcc&chksm=ec3cf1b2db4b78a45b3578e63ce4556034b97a6c1500e7eaf7747962afff1aca1ce5c8b42ec1&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



