来源:中国高科技
蛋白质发挥功能的“原位”环境是细胞,因此在细胞内开展蛋白质的结构和动力学研究对蛋白质功能的解析至关重要。细胞内大分子的浓度可以达到300-450g/L,拥挤的细胞环境可能会影响蛋白质的折叠,进而影响其功能。但是细胞环境如何影响蛋白质折叠过程目前并不很清晰。
近日,青岛能源所姚礼山研究员带领的蛋白质设计研究组在细胞内蛋白质折叠研究方面取得新进展。该研究以IgG结合蛋白质GB3的两个突变体MutX 和 MutY(图1)为研究体系,采用核磁共振技术,对其在细胞内的折叠态与解折叠态之间的构象交换进行了表征。结果表明蛋白在细胞内和缓冲溶液中的折叠和解折叠的动力学过程有较大差异(图1),折叠态、解折叠态和过渡态的相对自由能受到了细胞环境的影响(图2)。进一步研究表明,这一影响主要来自于细胞内的五级作用力,但这种作用力不足以改变蛋白质的折叠态和解折叠态的构象。该研究结果也表明离体条件下的蛋白质功能研究需要在细胞环境中进行独立验证。相关研究已发表于Journal of the American Chemical Society杂志上(JACS2019,DOI:10.1021/jacs.9b04435)。
以上研究由蛋白质设计研究组姚礼山研究员主持完成,获得国家重点研发计划项目、国家自然科学基金、山东省自然科学基金和山东省泰山学者项目的支持。
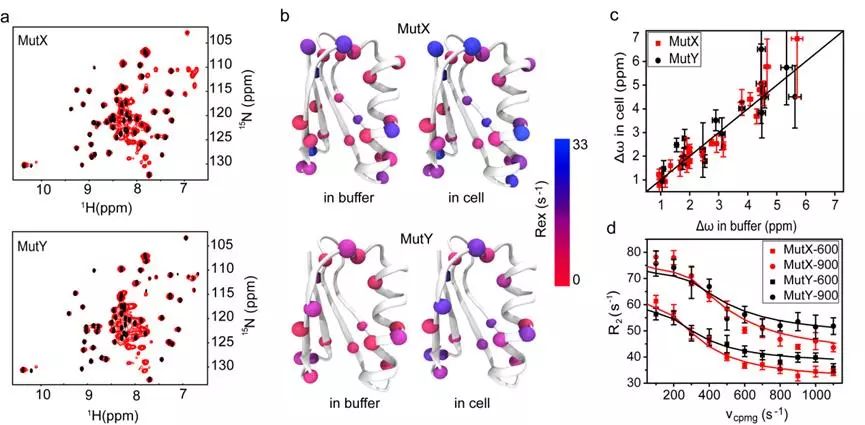
图1. GB3突变体 MutX和MutY在细胞内和水溶液的折叠与解折叠构象交换动力学的比较
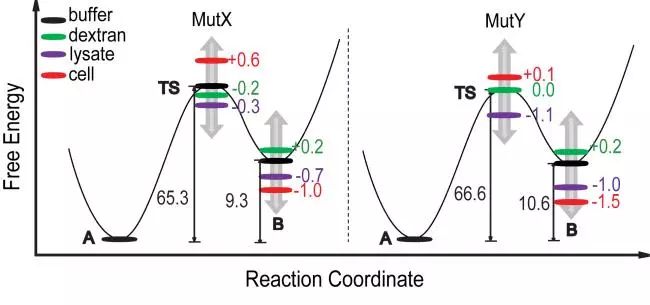
图2. GB3突变体 MutX和MutY在不同条件下的自由能图
附录:
Xiangfei Song, Tianhang Lv, Jingfei Chen, Jia Wang, and Lishan Yao*, Characterization of Residue Specific Protein Folding and Unfolding Dynamics in Cells, Journal of the American Chemical Society, 2019 (DOI:10.1021/jacs.9b04435)。
https://pubs.acs.org/doi/full/10.1021/jacs.9b04435
来源:cas-hitech 中国高科技
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MDczMTAzMA==&mid=2650046803&idx=2&sn=871a4e5011c2141dc68d7a64ca9037ee&chksm=8738752ab04ffc3c71202bd276b94c4a9b12853c9128678855ef51e865804e1ca8062364d924&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



