来源:BioArt
尽管近年来肺癌靶向治疗的成绩斐然,但肿瘤的快速复发及耐药使整体疗效并没有达到很理想的状态。肺癌细胞在受到靶向药物初次打击的情况下会如何适应后续的药物治疗?这种适应性反应的分子基础是什么?其是否能够持续性地遗传并形成细胞记忆?这些关键科学问题的解答将为我们深入理解肺癌靶向治疗耐药的进化过程及其中的关键事件奠定坚实的理论基础。
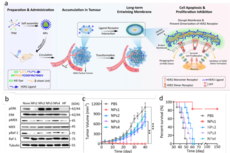
2019年7月9日,中国科学院生物化学与细胞生物学研究所季红斌研究组联合同济大学肺科医院周彩存课题组及北京大学李程课题组在Cell Reports杂志上发表了最新研究成果Branched-Chain Amino Acid Metabolic Reprogramming Orchestrates Drug Resistance to EGFR Tyrosine Kinase Inhibitors。在该项工作中,研究人员揭示了表观调控的代谢重编程在肺癌细胞适应并逃脱靶向治疗中的重要作用及分子机制。

在该项工作中,研究人员发现低剂量的靶向药物预处理会使EGFR突变的肺癌细胞进入药物耐受的状态,使肺癌细胞对后续更高剂量的靶向药物处理表现出适应性反应。低剂量药物的多次刺激能够强化这种适应性反应,从而表现出对高剂量药物较强的耐受。这种适应性反应不仅仅发生在EGFR突变的肺癌细胞中,在ALK融合的肺癌细胞中同样存在,提示这种对靶向药物的适应性反应可能是一种较为普遍的现象。
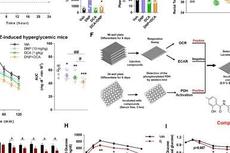
该项工作进一步揭示了这种适应性反应的分子基础,主要涉及表观遗传调控介导的代谢重编程。在肺癌细胞适应药物治疗的过程中,组蛋白H3K9甲基化水平会发生下调,从而诱导支链氨基酸氨基转移酶1(BCAT1)表达水平的上调,使肿瘤细胞更多地依赖支链氨基酸代谢来促进还原型谷胱甘肽的合成,最终实现有效地清除靶向治疗引发的胞内活性氧簇堆积来逃脱药物处理。
研究者针对性地联合ROS诱导药物和靶向治疗药物可以有效地克服肺癌耐药。临床数据分析同样发现, BCAT1高表达与肺癌患者的预后显著相关,而且其高表达往往提示靶向治疗单药处理的疗效较差。
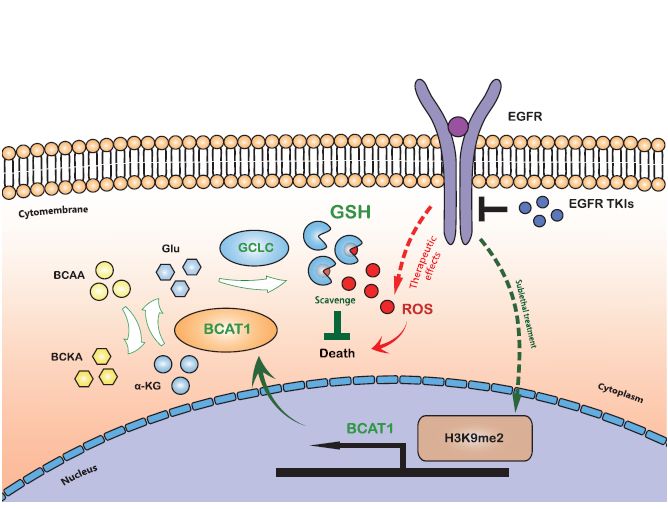
图:肺癌细胞适应靶向治疗药物处理的分子基础:H3K9me2失调介导的支链氨基酸代谢重编程。
该研究不仅仅揭示了肺癌细胞在接受药物打击时的适应性反应及其分子基础,而且提示这种适应性反应可能是导致肺癌耐药的一个新机制,而联合靶向治疗药物和ROS诱导药物可能是克服肺癌耐药的一个潜在的新策略。
据悉,生化与细胞所博士生王月桐、张箭、同济大学附属肺科医院任胜祥教授以及生化与细胞所博士后孙丹是该论文的共同第一作者。季红斌研究员、同济大学附属肺科医院周彩存教授、生化与细胞所胡良副研究员以及北京大学生命科学学院李程教授是该论文的共同通讯作者。
原文链接:
https://doi.org/10.1016/j.celrep.2019.06.026
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652472353&idx=4&sn=7d03e8e6744d7124eb6b21722a5086f5&chksm=84e21795b3959e83c4ae37626110b2877dbd5ed49ab966b542a280aaa56afdc5bb9df9bc426e&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn