来源:生物通
研究表明人类早期胚胎发育中的组蛋白重编程具有高度的物种特异性。
近日,郑州大学第一附属医院孙莹璞/徐家伟课题组、清华大学生命科学院颉伟课题组合作研究揭示了人类早期胚胎发育组蛋白修饰重编程规律,发现人类早期胚胎发育染色质独特的亲本到合子表观基因组的转换模式,提出“Epigenome rebooting(表观基因组重启)”模型。研究成果以“Resetting histone modifications during human parental-to-zygotic transition”(人类亲本-合子转变中组蛋白修饰重编程)为题,以研究论文的形式于2019年7月4日在Science(《科学》)在线发表。郑州大学第一附属医院孙莹璞教授、清华大学颉伟研究员以及郑州大学第一附属医院徐家伟教授为本文通讯作者,夏炜坤博士(清华大学)、徐家伟教授(郑州大学第一附属医院) 、于广博士(清华大学)、姚桂东副研究员(郑州大学第一附属医院)为本文共同第一作者。
表观遗传学修饰参与基因表达调控并调控个体发育。在哺乳动物早期发育过程中,卵母细胞受精形成具有全能性的受精卵,并经过细胞分裂与分化形成植入前囊胚,后者包含具有多能性的内细胞团。伴随着发育的进行,表观遗传学修饰经历了剧烈的重编程。
近年来,以小鼠等模式生物为研究模型,DNA甲基化、染色质开放性、染色质高级结构以及组蛋白修饰等表观遗传学特征的动态变化过程和规律都逐渐被揭示。在小鼠卵细胞发育晚期组蛋白修饰H3K4me3和H3K27me3会以非经典的形式分布,并通过母源继承的方式传递到胚胎中调控子代的基因表达和发育。由于人类卵细胞和早期胚胎样本稀缺性以及极低量细胞组蛋白修饰技术的缺乏,人类早期胚胎发育中组蛋白修饰的重编程规律以及功能并不清楚。
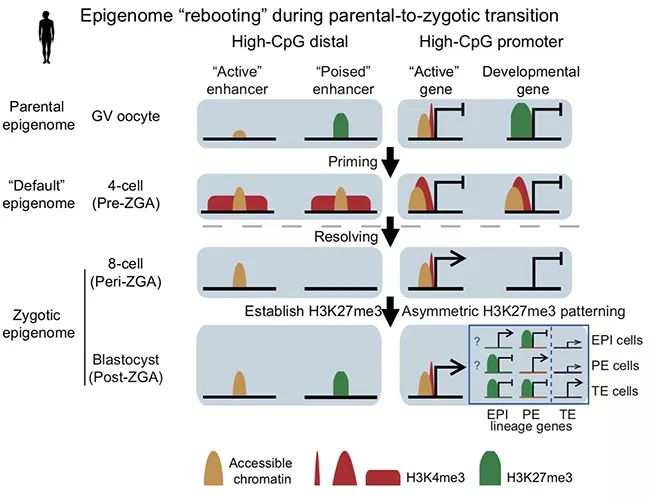
研究团队优化并建立了可识别低至50个细胞中的组蛋白修饰染色质定向捕获分割技术(CUT&RUN),并针对人类早期胚胎样本进行了优化,进一步在人类卵母细胞、合子基因组激活(ZGA)前后胚胎和内细胞团等时期检测了H3K4me3和H3K27me3的动态变化,在ZGA后的胚胎中检测了H3K27ac的分布:研究发现人类早期胚胎发育过程中的组蛋白重编程经历了和小鼠不同的动态变化。在人卵细胞中,H3K4me3没有呈现非经典的分布模式,而依然集中分布于基因的启动子区域。
同时,H3K27me3依然富集于它的经典靶位点—发育基因的启动子区域。在受精后,不同于小鼠中母源H3K27me3能维持较长的时间,人类的H3K27me3在ZGA前被大规模地去除;H3K4me3则在ZGA前出现在许多启动子区域以及基因远端开放区域。
ZGA后随着H3K4me3转变为经典分布的形式和随后H3K27me3的重新建立,这些区域会分解成为激活或抑制的状态。研究团队发现ZGA前的H3K4me3建立和DNA的序列特征有很好的相关性,并在部分程度上具有类似小鼠卵细胞中非经典H3K4me3的特征,H3K4me3的出现也伴随着这些区域染色质开放的建立。研究团队将这种H3K4me3称之为预备性的H3K4me3(priming H3K4me3)状态,将 ZGA前的染色质状态称之为“默认”状态,并提出“表观基因组重启”模型:精子、卵子受精后,人类早期胚胎清除亲本的表观遗传记忆(内存清理),重构初始化状态(加载基础架构),重建表观基因组调控细胞分化(加载高级功能模块)。
已有小鼠的研究表明,母源的H3K27me3调控DNA甲基化非依赖性的基因印记,那么这一现象在人类中是否保守呢?
通过分析小鼠中H3K27me3依赖的基因印记同源基因以及XIST,发现绝大多数基因没有被H3K27me3标记,即使少数基因被H3K27me3标记但是也不表达,因此这些基因不大可能受到母源遗传的H3K27me3调控,H3K27me3在人类ZGA前被大规模去除,也没有调控XIST的表达和X染色质失活,因此也不太可能作为一种基因组印记形式。人类和小鼠H3K4me3和H3K27me3重编程的差异可能和相关修饰酶在物种间差异性的表达有关,研究表明人类早期胚胎发育中的组蛋白重编程具有高度的物种特异性。
获悉胚胎基因组激活前“基因组重启”后,团队进一步关注胚胎ZGA后转录调控通路,采用MARINa算法寻找了发育阶段特异性的转录激活因子,令人惊喜的是“分化转录通路图谱”正确预测了已知的胚胎细胞向EPI, PE 和TE分化相关转录调控因子,并鉴定了新的潜在转录因子可能调控细胞分化。
研究人员进一步研究通过D5、D6和D7囊胚的TE与ICM发现ICM和TE不对称的表观遗传类型。研究团队结合染色质图谱和已发表的单细胞转录数据,预测了人类各谱系的关键调控因子。并发现在人囊胚的内细胞团和滋养外胚层中,许多内细胞团(包括上胚层和原始内胚层)的特异基因会被H3K27me3所标记,而滋养外胚层的特异基因则几乎没有这样的标记,揭示不同谱系基因在早期发育分化过程中具有差异性表观遗传调控,这种标记模式可能和不同谱系命运决定的差异相关。
该研究系统分析了人类早期胚胎组蛋白修饰重编程规律,阐明了人类特有的组蛋白修饰动态变化规律,揭示了“表观基因组重启”机制,研究成果对于认识人类生命起始以及辅助生殖技术中胚胎的早期发育和调控规律具有重要理论意义。该研究获得了国家自然科学基金委、国家科技部、北京市科委和生命科学联合中心以及美国霍华德休斯医学研究所国际研究学者等多个项目的支持,同时该课题得到了河南省科技厅生殖与遗传重点实验室、河南省妇产疾病(生殖医学)临床医学研究中心,清华大学实验动物中心、生物医学测试中心基因测序平台以及计算平台的大力协助和支持。北京大学前沿交叉学科研究院博士生许锴、郑州大学第一附属医院马雪山和博士生张楠在课题中做出了重要贡献。合作实验室还包括清华大学那洁课题组。
参考文献:
Resetting histone modifications during human parental-to-zygotic transition
来源:gh_c1fce5726992 生物通
原文链接:https://mp.weixin.qq.com/s?__biz=MjM5NzMwNjYyMg==&mid=2675529935&idx=6&sn=593f8c382b04d619cab1404db1f828e5&scene=0#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



