来源:BioArt
溴结构域(bromodomain)是一类能够特异性识别赖氨酸乙酰化(Kac)的蛋白结构域,亦被称作乙酰化‘阅读器’(‘reader’)【1】。通过结合组蛋白或非组蛋白上的乙酰化标记,溴结构域参与染色质重构及基因转录等过程的调控。研究表明,溴结构域功能异常可导致诸如癌症等人类疾病的发生,而抑制溴结构域的相关活性则被视为疾病治疗的新策略。在过去十年中,以JQ1【2】和I-BET【3】为代表的多种不同结构类型溴结构域抑制剂被报道。一部分在临床前研究中显示出良好效果的抑制剂已进入到不同阶段的临床试验当中【4】。
人类基因组共编码61个溴结构域,存在于42个溴结构域蛋白(bromodomain-containing protein)中。因不同溴结构域之间结构相似性较高,对于溴结构域抑制剂选择性的评价就显得尤为重要。在实际应用中,低选择性的抑制剂有可能造成脱靶效应(off-target effect)或出现副作用(side effect)。大多数溴结构域抑制剂选择性评价依赖基于重组单蛋白(recombinant single protein)的体外(in vitro)评价方法,包括差式扫描荧光法(differential scanning fluorimetry),表面等离子共振法(surface plasmon resonance), 生物膜干涉法(bio-layer interferometry),Alpha筛选(AlphaScreen)及荧光偏正法(fluorescence polarization)等【5-6】。尽管上述体外评价方法应用广泛,但所得结果可能与胞内真实状况不同。
溴结构域蛋白一般含有多个不同的结构域,并且在细胞内与其他蛋白组成蛋白复合物(protein complex)发挥作用。单个溴结构域的结构可在与相同蛋白邻近结构域或不同蛋白的相互作用中发生改变,从而影响该溴结构域与其抑制剂的结合,造成与体外选择性研究相异的结果。目前常用的活细胞内评价溴结构域抑制剂的方法有荧光光漂白后恢复法(fluorescence recovery after photobleaching)【7】和基于Nanoluc荧光素酶的生物发光共振能量转移法(Nanoluc luciferase-based bioluminescence resonance energy transfer)【8】。虽然上述两种方法可在活细胞内对溴结构域抑制剂的活性进行评价, 但需要指出的是,为了满足光学信号的测量,测评对象依然是外源性(exogenous)的重组融合蛋白,而非内源性(endogenous)溴结构域,并且外源性重组蛋白在细胞内过表达(overexpress)的需求也决定了此二种方法低通量的本质,即无法一次性评价抑制剂对不同溴结构域的选择性。综合来看,领域内尚缺乏在活细胞内针对内源性溴结构域进行抑制剂选择性评价的有效方法。
2019年7月7日,香港大学化学系李祥(Xiang David Li)课题组在J. Am. Chem. Soc.杂志发表题为Chemical Proteomic Profiling of Bromodomains Enables the Wide-Spectrum Evaluation of Bromodomain Inhibitors in Living Cells的研究论文。在该项研究中,作者开发了一种新型光亲和性溴结构域广谱探针,将此探针运用于竞争性基于活性的蛋白质组分析(competitive ABPP),并与计量蛋白质组学技术SILAC联用, 作者实现了在细胞内一次性针对不同内源性溴结构域进行抑制剂的选择性评价。

利用ABPP【9】进行抑制剂评价的基础是需要一个基于活性的化学探针,且该探针能够共价捕获尽可能多的目标蛋白(proteins of interest),在此项研究中即内源性溴结构域。2016年,牛津大学的Filippakopoulos和Knapp团队报道了一个非特异性溴结构域抑制剂bromosporine,该抑制剂对多个溴结构域均有较好的抑制活性【10】。李祥团队以此为基础,在bromosoprine分子内引入一个含有双吖丙啶(diazirine)和末端炔基(terminal alkyne)的片段得到光亲和探针(photoaffinity probe)photo-BS。作者首先选取了21个不同的溴结构域与photo-BS进行孵育,并经紫外光激发进行光交联,之后将捕获到的蛋白通过click反应与荧光基团(罗丹明)相连。荧光扫面显示,全部21个受试蛋白均能被photo-BS标记,且标机效率(EC50)随bromosproine与受试蛋白亲和力(Kd)的增加而增加。
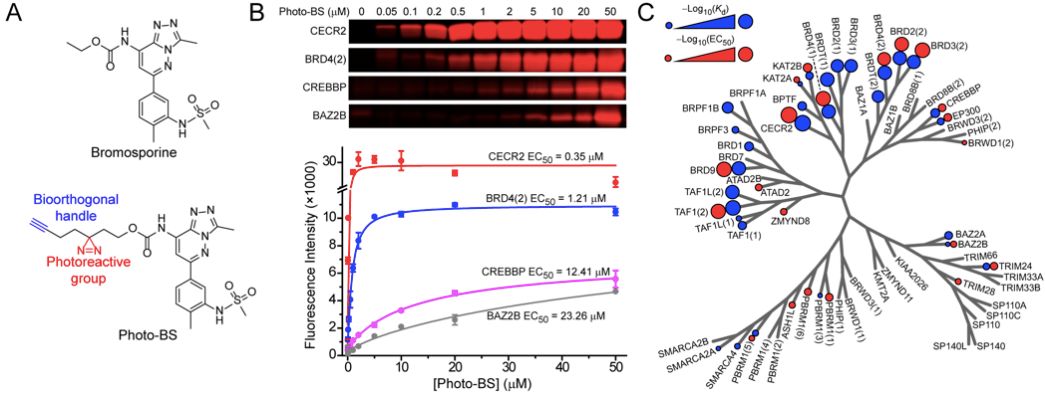
随后,作者利用不同的溴结构域抑制剂与探针进行竞争。结果显示,bromosporine能够在不同程度上竞争掉探针对21个溴结构域的标记。而特异性抑制剂,例如JQ1和PFI-1仅能够抑制住探针对其靶标蛋白BRD4(1)及BRD4(2)的标记。这一选择性竞争的现象与预期相符。
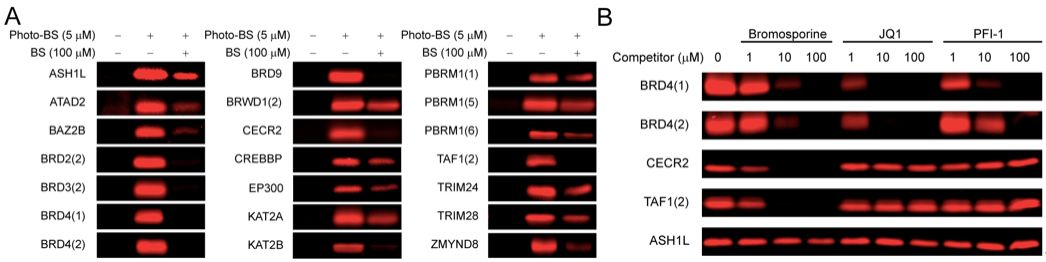
基于体外实验的结果,作者进一步利用SILAC技术【11】,在HEK293T和U2OS两种细胞系中检测了photo-BS探针在细胞内捕获内源性溴结构域的能力。通过对比紫外光激发后探针共孵育细胞与未经探针处理细胞之间下拉实验(pull-down)所得蛋白的SILAC比例,作者发现共有28个已知的内源性溴结构域蛋白能够被photo-BS富集(SILAC比例,探针处理:未处理>2),占到了已知42个溴结构域蛋白的三分之二。这一结果证明photo-BS针对内源性溴结构域蛋白有较好的广谱捕获效力。
最后,作者选取了两个不同的溴结构域抑制剂在细胞内与photo-BS进行竞争性试验,并通过SILAC技术定量分析被竞争掉的靶标蛋白。针对bromosporine的实验表明,该抑制剂在细胞内的主要靶标为BRD2、BRD3、BRD4、BRD7及BRD9,与先前报道的结果相吻合【10】。当选取BRPF1溴结构域特异性抑制剂GSK6853为研究对象时,SILAC结果显示在所有被photo-BS捕获的溴结构域蛋白中,仅有BRPF1的富集被GSK6853选择性抑制,表明BRPF1为该化合物的特异性靶标,同样与已有研究结果相吻合【12】。
综上,此项研究开发了首个在活细胞内针对内源性溴结构域进行抑制剂选择性评价的有效方法,有望在未来研究中助力新型溴结构域抑制剂的发现。
李祥课题组的李歆博士和吴一哲博士为此论文共同第一作者,李祥副教授为唯一通讯作者。蛋白质组学样品分析由清华大学蛋白质组学平台邓海腾团队完成。香港城市大学孙红艳实验室提供部分受试溴结构域蛋白。
原文链接:
https://pubs.acs.org/doi/pdf/10.1021/jacs.9b02738
制版人:珂
参考文献
1. Marmorstein, R.; Zhou, M. M., Writers and readers of histone acetylation: structure, mechanism, and inhibition. Cold Spring Harb Perspect Biol 2014, 6 (7), a018762.
2. Filippakopoulos, P.; Qi, J.; Picaud, S.; Shen, Y.; Smith, W. B.; Fedorov, O.; Morse, E. M.; Keates, T.; Hickman, T. T.; Felletar, I.; Philpott, M.; Munro, S.; McKeown, M. R.; Wang, Y.; Christie, A. L.; West, N.; Cameron, M. J.; Schwartz, B.; Heightman, T. D.; La Thangue, N.; French, C. A.; Wiest, O.; Kung, A. L.; Knapp, S.; Bradner, J. E., Selective inhibition of BET bromodomains. Nature 2010, 468 (7327), 1067-73.
3. Nicodeme, E.; Jeffrey, K. L.; Schaefer, U.; Beinke, S.; Dewell, S.; Chung, C. W.; Chandwani, R.; Marazzi, I.; Wilson, P.; Coste, H.; White, J.; Kirilovsky, J.; Rice, C. M.; Lora, J. M.; Prinjha, R. K.; Lee, K.; Tarakhovsky, A., Suppression of inflammation by a synthetic histone mimic. Nature 2010, 468 (7327), 1119-23.
4. Filippakopoulos, P.; Knapp, S., Targeting bromodomains: epigenetic readers of lysine acetylation. Nat Rev Drug Discov 2014, 13 (5), 337-56.
5. Ciulli, A., Biophysical screening for the discovery of small-molecule ligands. Methods Mol Biol 2013, 1008, 357-88.
6. Zolotarjova, N. I.; Wynn, R., Binding Assays for Bromodomain Proteins: Their Utility in Drug Discovery in Oncology and Inflammatory Disease. Curr Protoc Pharmacol 2018, 80 (1), 3.16.1-3.16.14.
7. Philpott, M.; Rogers, C. M.; Yapp, C.; Wells, C.; Lambert, J. P.; Strain-Damerell, C.; Burgess-Brown, N. A.; Gingras, A. C.; Knapp, S.; Muller, S., Assessing cellular efficacy of bromodomain inhibi-tors using fluorescence recovery after photobleaching. Epigenetics Chromatin 2014, 7, 14.
8. Machleidt, T.; Woodroofe, C. C.; Schwinn, M. K.; Mendez, J.; Robers, M. B.; Zimmerman, K.; Otto, P.; Daniels, D. L.; Kirkland, T. A.; Wood, K. V., NanoBRET--A Novel BRET Platform for the Analysis of Protein-Protein Interactions. ACS Chem Biol 2015, 10 (8), 1797-804.
9. Niphakis, M. J.; Cravatt, B. F., Enzyme inhibitor discovery by activity-based protein profiling. Annu Rev Biochem 2014, 83, 341-77.
10. Picaud, S.; Leonards, K.; Lambert, J. P.; Dovey, O.; Wells, C.; Fedorov, O.; Monteiro, O.; Fujisawa, T.; Wang, C. Y.; Lingard, H.; Tallant, C.; Nikbin, N.; Guetzoyan, L.; Ingham, R.; Ley, S. V.; Brennan, P.; Muller, S.; Samsonova, A.; Gingras, A. C.; Schwaller, J.; Vassiliou, G.; Knapp, S.; Filippakopoulos, P., Promiscuous targeting of bromodomains by bromosporine identifies BET proteins as master regulators of primary transcription response in leukemia. Sci Adv 2016, 2 (10), e1600760.
11. Ong, S. E.; Blagoev, B.; Kratchmarova, I.; Kristensen, D. B.; Steen, H.; Pandey, A.; Mann, M., Stable isotope labeling by amino acids in cell culture, SILAC, as a simple and accurate approach to expression proteomics. Mol Cell Proteomics 2002, 1 (5), 376-86.
12. Bamborough, P.; Barnett, H. A.; Becher, I.; Bird, M. J.; Chung, C. W.; Craggs, P. D.; Demont, E. H.; Diallo, H.; Fallon, D. J.; Gordon, L. J.; Grandi, P.; Hobbs, C. I.; Hooper-Greenhill, E.; Jones, E. J.; Law, R. P.; Le Gall, A.; Lugo, D.; Michon, A. M.; Mitchell, D. J.; Prinjha, R. K.; Sheppard, R. J.; Watson, A. J.; Watson, R. J., GSK6853, a Chemical Probe for Inhibition of the BRPF1 Bromodomain. ACS Med Chem Lett 2016, 7 (6), 552-7.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652472161&idx=5&sn=dd6bb00af8c025bcba78715c08af7cfd&chksm=84e210d5b39599c307752d7e79048824a886c8d4871a72d58cd71b5ec003afd82b77711d0125&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn


