来源:BioArt
随着现代社会的发展与生活节奏的加快,人们的压力应激显著增加。长期慢性压力应激会导致人体出现各类疾病包括情绪障碍、骨质疏松以及代谢异常等。早在70、80年代,临床研究就发现焦虑症或抑郁症的病人的骨密度低于常人;提示压力应激导致的焦虑可能与骨丢失密切相关,但生物学机制尚不清楚。在航天医学中,传统观点认为航天员骨丢失是由于外太空环境的重力缺失引起的,然而近年来研究发现航天员即使长时间锻炼后骨量仍有持续性丢失,提示长期密闭隔离造成的慢性压力应激可能加剧航天员的骨丢失【1】。压力应激下大脑的功能状态可能通过神经系统对外周骨代谢产生持续的负面影响作用,然而迄今为止该作用的生物学机制尚不清楚。
2020年9月10日,中国科学院深圳先进技术研究院(以下简称“先进院”)杨帆研究员、中国航天员科研训练中心李莹辉研究员与先进院的王立平研究员合作(杨帆研究员与博士生刘运辉为论文的共同第一作者)在The Journal of Clinical Investigation杂志上在线发表了题为A GABAergic neural circuit in the ventromedial hypothalamus mediates chronic stress-induced bone loss(下丘脑腹内侧区GABA能神经回路介导慢性应激性骨丢失)的研究长文。该研究发现一条由终纹床核(the bed nucleus of the stria terminalis, BNST)到下丘脑腹内侧核(the ventromedial hypothalamus, VMH)再到孤束核(the nucleus tractus solitaries, NTS)构成的神经环路通过调节外周交感神经系统活动调节慢性压力应激诱发的骨丢失过程。
 为了深入解析其生物学机制,先进院与中国航天员科研训练中心合作通过六年的潜心研究终于在应激诱发骨丢失神经机制解析领域获得重要进展。合作研究团队首先在人体实验中发现长期密闭隔离可以导致受试者出现明显上升的焦虑情绪与骨丢失症状;确认了压力应激与骨丢失的直接相关性。接着,研究人员利用不可预测慢性轻度应激小鼠模型(Unpredictable chronic mild-stress model, UCMS)解析压力应激诱发骨丢失的神经机制;他们发现经过长慢性压力应激刺激的小鼠表现出明显的焦虑样行为:压力应激刺激组小鼠在旷场实验中进入中心区的次数及探索时间明显低于正常对照组;同时,它们在高架十字迷宫中他们进入开放臂的次数与探索时间也远低于对照组;而micro-CT扫描分析发现压力应激组小鼠的骨密度明显低于正常对照小鼠。该结果再次验证了压力应激与骨丢失的相关性。通过电生理纪录技术,研究人员发现焦虑小鼠的VMH核团中SF-1神经元(steroidogenic factor-1, 类固醇生成因子1)的抑制性突触后电流(inhibitory postsynaptic currents, iPSCs)明显高于正常小鼠。提示VMH脑区的抑制性神经元/神经末梢(GABA能)可能在压力应激诱发的焦虑状态维持及骨代谢调控中扮演重要角色。为验证这一假说,研究人员选用一种GABA能神经元携带兴奋性光遗传元件的VGAT-ChR2转基因小鼠,利用蓝光刺激可以激活GABA能神经元活动【2】。他们发现兴奋VMH脑区的GABA能神经元/神经末梢可诱发小鼠出现明显的焦虑样行为,并伴有骨丢失症状。
为了深入解析其生物学机制,先进院与中国航天员科研训练中心合作通过六年的潜心研究终于在应激诱发骨丢失神经机制解析领域获得重要进展。合作研究团队首先在人体实验中发现长期密闭隔离可以导致受试者出现明显上升的焦虑情绪与骨丢失症状;确认了压力应激与骨丢失的直接相关性。接着,研究人员利用不可预测慢性轻度应激小鼠模型(Unpredictable chronic mild-stress model, UCMS)解析压力应激诱发骨丢失的神经机制;他们发现经过长慢性压力应激刺激的小鼠表现出明显的焦虑样行为:压力应激刺激组小鼠在旷场实验中进入中心区的次数及探索时间明显低于正常对照组;同时,它们在高架十字迷宫中他们进入开放臂的次数与探索时间也远低于对照组;而micro-CT扫描分析发现压力应激组小鼠的骨密度明显低于正常对照小鼠。该结果再次验证了压力应激与骨丢失的相关性。通过电生理纪录技术,研究人员发现焦虑小鼠的VMH核团中SF-1神经元(steroidogenic factor-1, 类固醇生成因子1)的抑制性突触后电流(inhibitory postsynaptic currents, iPSCs)明显高于正常小鼠。提示VMH脑区的抑制性神经元/神经末梢(GABA能)可能在压力应激诱发的焦虑状态维持及骨代谢调控中扮演重要角色。为验证这一假说,研究人员选用一种GABA能神经元携带兴奋性光遗传元件的VGAT-ChR2转基因小鼠,利用蓝光刺激可以激活GABA能神经元活动【2】。他们发现兴奋VMH脑区的GABA能神经元/神经末梢可诱发小鼠出现明显的焦虑样行为,并伴有骨丢失症状。
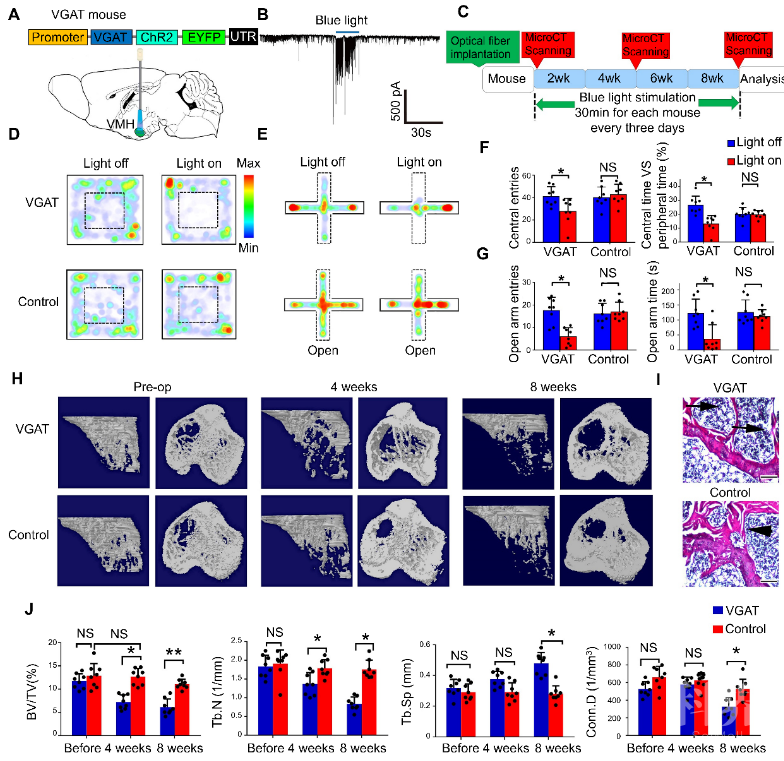 图1:选择性激活VMH脑区的GABA能神经末梢可诱发小鼠表现出焦虑样行为及骨丢失
图1:选择性激活VMH脑区的GABA能神经末梢可诱发小鼠表现出焦虑样行为及骨丢失GABA能包含诸多亚类,那么在VMH中调控焦虑及骨丢失的GABA能神经元到底是哪一个亚类呢?通过免疫染色,他们发现VMH存在大量的SOM(Somatostatin, 生长抑素)阳性的神经末梢,而其他常见的GABA能亚类则鲜有分布;而且VMH脑区的GABA能神经元胞体很少,提示这些SOM神经末梢可能来自上游核团,通过调节VMH神经元来调控焦虑及骨丢失。利用神经环路示踪技术,研究人员发现多个脑区可以投射到VMH;其中一个叫做终纹床核 (BNST) 的脑区引起了他们的注意;该脑区在调控动物焦虑情绪中扮演重要角色,而且该脑区存在大量的SOM神经元胞体。
为研究BNST脑区SOM神经元在压力应激性骨丢失中的作用,研究人员在SOM-cre小鼠的BNST脑区注射携带兴奋性光遗传学元件ChR2的病毒,而在VMH脑区埋植光纤。选择性刺激由BNST投射到VMH脑区的SOM神经末梢。他们发现兴奋这一条BNST-VMH环路可以诱发小鼠表现出明显的焦虑样行为和骨丢失症状。相反的,当他们选择性抑制BNST中的SOM神经元时可以有效预防经压力应激处理的小鼠出现焦虑和骨丢失。
那么,这条BNST-VMH环路的下游核团又是什么呢?为解析完整的压力应激性骨丢失调控环路,研究人员向小鼠胫骨注射跨多级逆向神经环路示踪病毒。他们分别在NTS, VMH和BNST发现阳性信号,提示NTS可能是BNST-VMH环路的下游。为验证这一猜想,他们利用三级环路标记技术(viral-genetic tracing of the input-output organization of the central neural circuit, TRIO)【3】发现NTS的Vglut2神经元确实接受VMH脑区SF-1神经元的直接投射,而且这些SF-1神经元就是接受BNST核团SOM神经元投射的那一群。那么,这些NTS中的Vglut2神经元是否参与骨代谢调控呢?研究人员发现,利用药物遗传学技术选择性抑制这些NTS中的Vglut2神经元可以诱发明显的骨丢失现象。
下一个吸引研究人员的问题是这条BNST-VMH-NTS环路通过什么样的机制调控外周骨代谢呢?研究人员发现焦虑动物血清中的去甲肾上腺素水平明显高于正常动物,提示交感神经活动可能参与了压力应激诱发的焦虑及骨丢失。利用TH-cre转基因动物,研究人员发现抑制骨组织中的交感神经末梢可有效缓解骨丢失症状。当他们选择性敲除骨细胞中的β2受体时,压力应激可以诱发焦虑行为,但并不导致骨丢失。
该研究首次分别在实验动物水平和人体实验验证了压力应激与骨丢失的相关性。更重要的是,他们发现了压力应激性骨丢失的调控机制:压力应激激活BNST中的SOM神经元,这些SOM神经元抑制下游的VMH中的SF-1神经元;而这些被抑制的SF-1神经元减弱了对下游NTS中Vglut2神经元的兴奋作用,促使外周交感神经系统活动度升高,分泌更多的去甲肾上腺素(Norepinephrine, NE);这些NE通过作用于骨细胞上的β2受体来抑制成骨作用并促进破骨作用,最终诱发骨丢失的发生。该重要机制的发现,不仅为我们深入理解大脑调控外周脏器功能的神经机制提供了新的思路,同时也为系统研究密闭隔离环境下大脑稳态对机体代谢、内分泌功能的调控机制提供了新的研究视角。
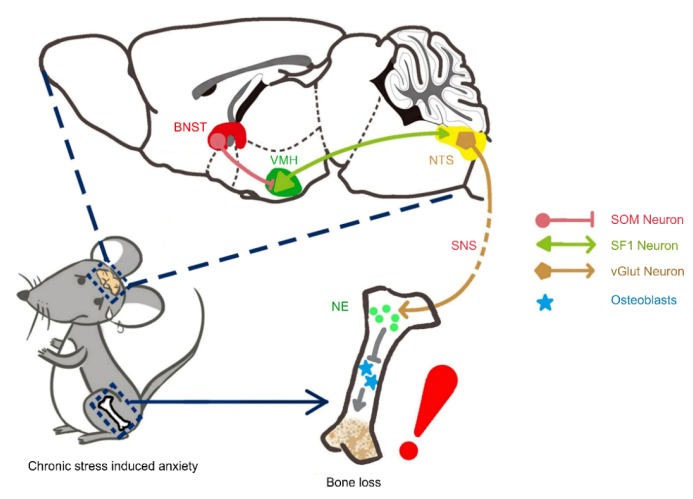 图2:中枢神经环路调控外周骨代谢:BNSTSOM-VMHSF-1-NTSVglut2神经环路通过调节外周交感神经活动调节慢性压力应激诱发的骨丢失过程。
图2:中枢神经环路调控外周骨代谢:BNSTSOM-VMHSF-1-NTSVglut2神经环路通过调节外周交感神经活动调节慢性压力应激诱发的骨丢失过程。王韵(北京大学教授、北京大学基础医学院副院长、北京大学神经科学研究所副所长,国家杰出青年基金获得者。)
压力应激导致的焦虑与抑郁等情绪障碍是影响人类健康的重要问题,长期慢性压力应激会引发情绪障碍、骨质疏松和糖尿病等各类疾病。近年来临床研究发现,压力应激导致骨量减少与骨密度显著下降,但其机制尚不清楚。先进院科研团队与中国航天员科研训练中心团队合作,首先通过人体密闭/隔离空间实验验证了慢性压力应激与骨丢失的相关性;结合光遗传/药物遗传学,电生理,行为学与骨代谢分析,他们在动物模型中解析出一条由前脑-下丘脑-脑干中的特定神经元类型构成的神经环路调控外周交感神经活动,通过成骨细胞上的β2受体调控骨代谢。中枢神经与外周器官的交互调控研究将为解析情绪障碍与代谢功能紊乱(如压力应激诱发的骨代谢和糖代谢紊乱等)的生物学机制提供新的研究视角;杨帆等人的发现不仅有助于深入理解焦虑状态大脑调控骨代谢的机制,明确调控骨代谢的中枢靶点,还将为临床制定干预情绪障碍诱发的骨丢失的策略提供新的思路。
参考文献
1. Vico L, van Rietbergen B, Vilayphiou N, Linossier MT, Locrelle H, Normand M, et al. Cortical and Trabecular Bone Microstructure Did Not Recover at Weight-Bearing Skeletal Sites and Progressively Deteriorated at Non-Weight-Bearing Sites During the Year Following International Space Station Missions. Journal of bone and mineral research : the official journal of the American Society for Bone and Mineral Research. 2017.
2. Zhao S TJ, Atallah HE, Qiu L, Qiu L, Tan J, Gloss B, Augustine GJ, Deisseroth K, Luo M, Graybiel AM, Feng G. Cell type–specific channelrhodopsin-2 transgenic mice for optogenetic disp of neural circuitry function. Nat Methods. 2011;8(9):745-52.
3. Schwarz LA, Miyamichi K, Gao XJ, Beier KT, Weissbourd B, DeLoach KE, et al. Viral-genetic tracing of the input-output organization of a central noradrenaline circuit. Nature. 2015;524(7563):88-92.
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652499245&idx=5&sn=7a0b5a5d259a371f4800dd48a91cbaa8&chksm=84e27e99b395f78f9e94efbdc8f90411b4f78f04bf012ad0df8d490aaec5aedd8d0f6fe321f8#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn



